
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЗАДАНИЕ №4. ТИПОВЫЕ ЗАДАЧИ.
ЗАДАНИЕ №4
ОКСИДИМЕТРИЯ. ПЕРМАНГАНАТОМЕТРИЯ.
I. Подготовить ответы на следующие вопросы:
1. Оксидиметрия: сущность метода, классификация, способ фиксирования момента эквивалентности; принцип расчета эквивалентов окислителей и восстановителей; применение метода в медицине.
2. Перманганатометрия: принцип метода, фиксирование момента эквивалентности, применение метода в медицине.
3. Окислительное действие перманганата калия в кислой, нейтральной и щелочной средах.
4. Приготовление раствора титранта – перманганата калия, условия его хранения.
II. Составить уравнения окислительно-восстановительных реакций взаимодействия перманганата калия в кислой среде со следующими восстановителями:
А) калий нитритом (KNO2);
Б) железо (II) сульфатом (FeSO4);
В) калий иодидом (KI);
Г) щавелевой кислотой (Н2С2О4);
Д) пероксидом водорода (Н2О2).
ЛИТЕРАТУРА:
1. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов мед. спец. вузов.- М.: Высшая школа, 2001. – С . 41 - 47.
2. Методическая разработка кафедры «Оксидиметрия. Перманганатометрия.»
ЗАДАНИЕ №5.
МЕТОД ПЕРМАНГАНАТОМЕТРИИ. ОПРЕДЕЛЕНИЕ ОБЩЕГО СОДЕРЖАНИЯ ПЕРОКСИДА ВОДОРОДА В РАСТВОРЕ
I. Повторить теорию ответов к вопросам по теме «Перманганатометрия» ( см. задание №4).
II. Подготовить решение задач к тестированному контролю.
ТИПОВЫЕ ЗАДАЧИ.
1. На примере конкретной реакции охарактеризовать окислительные свойства перманганата калия в щелочной среде и аргументировать возможность применения данной среды для перманганатометрических определений.
2. Рассчитать молярную концентрацию эквивалента раствора нитрита натрия, содержащего 13,8 г соли в 200 см3 раствора. Какой объем раствора перманганата калия с молярной концентрацией эквивалента 0,5 моль·дм-3 потребуется на титрование 10 см3 исходного раствора нитрита натрия?
Дано: Решение:
 m(NaNO2)=13,8 г 1. В процессе реакции:
m(NaNO2)=13,8 г 1. В процессе реакции:
Vр-ра(NaNO2)=200 см3 NaNO2 ÞNaNO3 , т.е.
С(1/5 KMnO4)=0,5 моль·дм-3 N+3 – 2 e Þ N+5
Vр-ра(NaNO2)=10 см3 M(1/2 NaNO2)=69/2=34,5 г·моль-1

С(1/2 NaNO2) - ? 2. Найти С(1/2 NaNO2):
Vp-pa(KMnO4) - ?
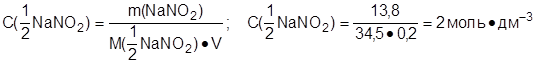 |
3. Найти объем раствора перманганата калия:
По закону эквивалентов:
С(1/2 NaNO2)·V(NaNO2) = C(1/5 KMnO4)·V(KMnO4);
откуда:
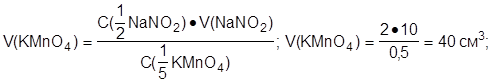 |
Ответ: C(1/2 NaNO2) = 2 моль·дм-3; V(KMnO4)=40 см3.
3. На титрование раствора пероксида водорода в кислой среде израсходовано 
25 см3 раствора перманганата калия с t(KMnO4)=0,008 г·см-3. Рассчитать массу пероксида водорода, содержащегося в исходном растворе:
Дано: Решение:
 t(KMnO4)=0,008 г·см-3 1. В процессе реакции:
t(KMnO4)=0,008 г·см-3 1. В процессе реакции:
V(KMnO4)=25 см3 Н2О2 –2e ® O2 + 2H+
 Mn+7 + 5e ® Mn+2
Mn+7 + 5e ® Mn+2
m( H2O2)-? M(1/2 H2O2) = 34 / 2 = 17 г·моль-1;
M(1/5 KMnO4) = 158 / 5 = 31,6 г·моль-1;
2. Рассчитать массу KMnO4, израсходованного на титрование:
m(KMnO4) = t (KMnO4) · V(KMnO4);
m(KMnO4) = 0,008·25 = 0,2 г.
3. По закону эквивалентов:
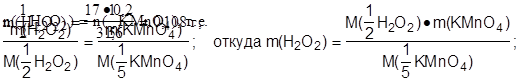 |
Ответ: m(H2O2) = 0,108 г.
4. Какую массу щавелевой кислоты H2C2O4·2H2O необходимо взять для приготовления 200 см3 раствора щавелевой кислоты с молярной концентрацией эквивалента С(1/2 H2C2O4·2H2O) = 0,02 моль·дм-3?
Дано: Решение:
 Vp-pa(H2C2O4)=200 см3 (0,2 дм3) 1. В процессе реакции:
Vp-pa(H2C2O4)=200 см3 (0,2 дм3) 1. В процессе реакции:
С(1/2 H2C2O4·2H2O) = 0,02 моль·дм-3 C2O42- - 2e ®2CO2
 M(1/2 H2C2O4·2H2O) = 126 / 2 = 63 г·моль-1
M(1/2 H2C2O4·2H2O) = 126 / 2 = 63 г·моль-1
m(H2C2O4·2H2O) - ? 2. Рассчитать m(H2C2O4·2H2O):
m(H2C2O4·2H2O) = M(1/2 H2C2O4·2H2O)·C(1/2 H2C2O4·2H2O)·Vp-pa;
m(H2C2O4·2H2O) = 63 · 0,02 · 0,2 = 1,26 г.
Ответ: m(H2C2O4·2H2O) = 1,26 г.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 131 – 138.
2. Методическая разработка кафедры «Обучающая программа по решению задач в теме «Перманганатометрия».
ЗАДАНИЕ №6.
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
I. Подготовиться к ответам на следующие вопросы:
1. Термодинамика. Основные понятия и термины. Система. Фаза. Классификация систем. Термодинамические параметры. Стандартные термодинамические параметры.
2. Термодинамические функции состояния системы. Внутренняя энергия. Первый закон термодинамики, формулировка, математическое выражение, философское значение, применение к биологическим системам.
3. Термодинамические функции состояния системы. Энтальпия. Энтропия. Энергия Гиббса. Химический потенциал.
4. Термохимия. Термохимические уравнения, их особенности. Закон Гесса. Энтальпии образования и сгорания. Стандартные энтальпии образования и сгорания. Следствия из закона Гесса, формулировки, математические выражения, примеры.
5. Понятие о коэффициенте калорийности пищи. Коэффициенты калорийности основных компонентов пищи: белков, жиров и углеводов.
II. Разобрать типовые задачи:
Задача №1. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков, 57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе.
РЕШЕНИЕ.
1. Найти массы белков (mб), углеводов (mу) и жиров (mж) в 450 г хлеба «Бородинский»:
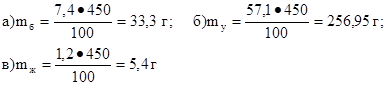 |
2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г:
К = (mб · 16,5 + mу · 16,5 + mж · 37,7) кДж
К = 33,3 · 16,5 + 256,95 ·16,5 + 5,4·37,7 = 4992,705 кДж
Ответ:К = 4992,705 кДж.
Задача №2. Определить изменение энтальпии химической реакции:
 2С2Н5ОН(ж) С2Н5 -О-С2Н5 (ж) + Н2О(ж) , используя
2С2Н5ОН(ж) С2Н5 -О-С2Н5 (ж) + Н2О(ж) , используя
следующие данные:
DН0сгор С2Н5ОН(ж) = - 1370,00 кДж·моль-1
DН0сгор С2Н5 ОС2Н5 (ж) = - 2720,04 кДж·моль-1
DН0сгор Н2О(ж) = 0 кДж·моль-1
РЕШЕНИЕ:
Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса запишем:
DН0р-я = SDН0сгор. реагентов - SDН0сгор.продуктов
Применительно к этой реакции:
DН0р-я = 2DН0сгор С2Н5ОН(ж) - DН0сгор С2Н5 ОС2Н5(ж) = 2·(-1370,00) – (- 2720,04) = = - 2740,00 + 2720,04 = - 19,96 кДж·моль-1.
Ответ: DН0р-я = - 19,96 кДж·моль-1.
Задача №3. Определить стандартную энтальпию образования оксида меди (II) CuO(к), используя следующие данные:
1). 3 CuO(К) + 2NH3(Г) = 3Cu(К) + N2(Г) + 3H2O(Ж), DH10 = - 299,53 кДж·моль-1
2). 1/2 N2(Г) + 3/2 H2(Г) = NH3(Г), DH20 = - 46,19 кДж·моль-1
3). H2(Г) + 1/2 О2(Г) = H2О(Ж), DH30 = - 285,838 кДж·моль-1
РЕШЕНИЕ:
Поскольку необходимо определить стандартную энтальпию образования оксида меди (II), то используя I-ое следствие из закона Гесса запишем:
DН0р-я = SDН0обр.продуктов - SDН0обр.реагентов
Применительно к 1-ой реакции:
DН0р-я = 3DН0обр Cu(к) + DН0обр N2(г) + 3DН0обр Н2О(ж) – (3DН0обр CuО(к) + +2DН0обр NH3(г)).
Учитывая, что в термохимии энтальпии образования простых веществ азота N2(г) и меди Cu(к) приняты равными нулю и раскрыв скобки, получаем следующее уравнение:
DН0р-я = 3DН0обр Н2О(ж) – 3DН0обр CuО(к) - 2DН0обр NH3(г).
Переносим в левую часть уравнения DН0обр CuО(к) с обратным знаком и получаем:
 |
Подставим числовые значения указанных параметров:
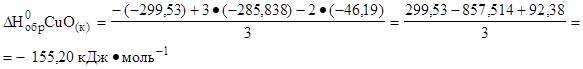 |
Ответ: DН0обр CuО(к) = - 155,20 кДж·моль-1.
Задача №4. Рассчитать величину стандартного изобарно-изотермического потенциала для следующей реакции:
 2C4H10(Г) + 5О2(Г) 4CH3COOH(Ж) +2Н2О(Ж), используя следующие данные:
2C4H10(Г) + 5О2(Г) 4CH3COOH(Ж) +2Н2О(Ж), используя следующие данные:
DН0р-я = -2267,94 кДж·моль-1
DS0р-я = -866,30 Дж·моль-1
РЕШЕНИЕ:
Поскольку даны значения энтальпийного и энтропийного факторов, то для расчета стандартного изобарно-изотермического потенциала используем следующее уравнение:
DG0р-я = DН0 - Т·DS0
Прежде, чем подставить в это уравнение значения указанных параметров, необходимо перевести величину энтропийного фактора в кДж·моль-1. Это будет составлять -0,866 кДж·моль-1.
Подставляем цифровые значения указанных величин в приведенное уравнение. При этом учитываем, что стандартная температура составляет 298k:
DG0р-я= -2267,94 - 298·(-0,866) = -2009,872 кДж·моль-1
Ответ:DG0р-я= -2009,872 кДж·моль-1
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 10 - 42.
2. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С. 47-54.
3. Материалы лекций.
ЗАДАНИЕ №7.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. БИОЭНЕРГЕТИКА.
I. Подготовиться к ответам на следующие вопросы:
1. Второй закон термодинамики, его формулировки. Энтропия и энергия Гиббса как критерии возможности самопроизвольного протекания процессов.
2. Химическое равновесие, константа равновесия. Термодинамическая характеристика химического равновесия. Уравнение изотермы химической реакции, условия равновесия и направления обратимых химических реакций.
3. Принцип Ле-Шателье, зависимость направления обратимых химических реакций от термодинамических параметров.
4. Применение термодинамики к биологическим системам. Особенности организации живых систем. Энергия пищевых веществ /продуктов питания/ как основной источник энергии для человеческого организма. Термодинамическая характеристика пищевых веществ и продуктов жизнедеятельности.
5. Стационарное состояние организма и механизмы его поддержания. Теорема Пригожина.
II. Подготовиться к лабораторной работе на тему: «Определение энтальпии реакции нейтрализации». Для этого необходимо знать ответы на вопросы:
1. Типы реакций нейтрализации /Ю.А.Ершов и др.,2003г. /, С. 119-120.
2. Изменение энтальпии при протекании реакций нейтрализации /А.С.Ленский,1989г./, С. 21-22.
III. Решить задачи:
1. Рассчитать изменение стандартной энергии Гиббса для химической реакции:
4HgS(Т) + 4CaO(K) = 4Hg(Ж) + 3CaS(K) +CaSO4(T);
Используя следующие данные:
DG0обр HgS(Т) = - 48,83 кДж·моль-1
DG0обр CaO(K) = - 604,2 кДж·моль-1
DG0обр Hg(Ж) = 0 кДж·моль-1
DG0обр CaS(K) = - 477,4 кДж·моль-1
DG0обр CaSO4(T) = - 1320,31 кДж·моль-1
Ответ: DG0р-я = - 140,39 кДж·моль-1.
2. Определить коэффициент калорийности для сахарозы С12Н22О11 в ккал·г-1, если стандартная энтальпия сгорания этого углевода равна – 5646,42 кДж·моль-1.
Ответ: 3,95 ккал·г-1.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 21-32, 35-38.
2. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С. 40-54.
3. Материалы лекций.
ЗАДАНИЕ №8
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. ОСМОС.
I. Подготовить ответы на следующие вопросы:
1. Осмос. Осмотическое давление растворов.
2. Уравнение Вант-Гоффа для электролитов и неэлектролитов.
3. Роль осмоса и осмотического давления в биологических системах. Изо-, гипер- и гипотонические растворы. Их применение в медицинской практике.
4. Гемолиз и плазмолиз.
5. Онкотическое давление крови.
II. Подготовиться к тестированному контролю знаний по теме «Осмос. Осмотические явления». Разобрать решение типовых задач.
ТИПОВЫЕ ЗАДАЧИ.
Задача №1: Вычислить осмотическое давление раствора неэлектролита, в 2 дм3 которого содержится 0,25 моль вещества при 200С.
Дано: Решение:
 |
 |
Vр-ра = 2 дм3 = 2·10-3 м3 p = C(x)·R·T или
T = 293К p = (0,25 / 2·10-3) · 8,314 · 293 = 3,045·105 Па =
R = 8,314 Дж·моль-1·К-1 = 304,5 кПа

p - ? Ответ: p = 3,045 · 105 Па.
Задача №2: При какой температуре (К) осмотическое давление раствора, содержащего 1,5 г хлорида калия в 1 дм3 раствора, составит 98450 Па?
Дано: Решение:
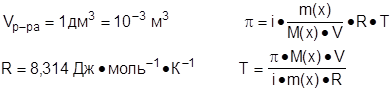 |
 p = 98450 Па Для раствора электролита:
p = 98450 Па Для раствора электролита:
m(KCl) = 1,5 г Для электролита хлорида калия:
 KCl « K+ + Cl- (a » 1, n = 2)
KCl « K+ + Cl- (a » 1, n = 2)
Т - ? i(KCl) = 1 + a·( n -1)
i(KCl) = 1 +1·(2-1) = 2
 |
M(KCl) = 74,5 г·моль-1
Ответ: T = 294,06 К.
Зададча №3: Вычислить массу рибозы С5Н10О5, содержащуюся в 4 дм3 раствора при 270С, если осмотическое давление раствора рибозы составляет 84802,8 Па.

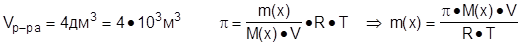 |
Дано: Решение:
Т = 300К M(С5Н10О5) = 150 г·моль-1
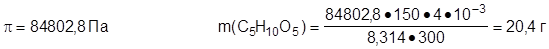 |
R = 8,314 Дж·моль-1·k-1
 |
m(С5Н10О5) - ?
Ответ: m(С5Н10О5) = 20,4 г.
Задача №4: Сравните величины осмотических давлений растворов, содержащих в 1 дм3 соответственно 0,02 моль сахарозы (С12Н22О11), NaCl, MgCl2, FeCl3 при 270С.
 Дано: Решение:
Дано: Решение:
Vр-ров = 1 дм3 = 10-3 м3 p = i·C(x)·R·T, т.е. при одинаковых величинах
n(x) = 0,02 моль С(x) и Т величины осмотических давлений растворов
Вещества: С12Н22О11, NaCl, зависят от величины изотонического коэффициента (i):
MgCl2, FeCl3 i = 1 +a·(n - 1)
 i (С12Н22О11) = 1, т.к. для неэлектролитов a = 0,
i (С12Н22О11) = 1, т.к. для неэлектролитов a = 0,
Сравнить pр-ров - ? i(NaCl) = 2,
i(MgCl2) = 3,
i(FeCl3) = 4.
Таким образом: p ( С12Н22О11) = С(X)·R·T
p ( NaCl ) = 2·С(X)·R·T
p ( MgCl2) = 3·С(X)·R·T
p (FeCl3) = 4·С(X)·R·T,
т.е. осмотическое давление будет больше в растворе FeCl3.
Ответ: p будет больше в растворе FeCl3.
III. Решить задачи:
1. При 00С осмотическое давление раствора глюкозы С6Н12О6 равно 56995,24 Па. Сколько граммов глюкозы содержится в 1 дм3 раствора? Ответ: m = 4,519 г.
2. Определить осмотическое давление раствора, содержащего 68,4 г сахарозы С12Н22О11 в 2 дм3 раствора при 270С. Ответ: p = 249420 Па.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 66 - 76.
2. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С.112 - 117.
3. Материалы лекций.
ЗАДАНИЕ №9
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ – pH.
I. Подготовить ответы на следующие вопросы:
1. Уравнение ионного произведения воды, его анализ.
2. Водородный и гидроксильный показатели среды.
3. Характеристика кислотности сред по величине pH.
4. Биологическое значение водородного показателя.
II. Разобрать решение типовых задач.
ТИПОВЫЕ ЗАДАЧИ:
Задача №1: Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·дм-3.
Дано: Решение:
 С(HCl) = 0,001 моль·дм-3 HCl « H+ + Cl-, т.к. a = 1, то
С(HCl) = 0,001 моль·дм-3 HCl « H+ + Cl-, т.к. a = 1, то
 [H+] = [HCl] = 10-3 моль·дм-3
[H+] = [HCl] = 10-3 моль·дм-3
рН - ? pH = -lg [H+]
pH = -lg10-3 = 3
Ответ: pH = 3.
Задача №2: Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10-2 моль·дм-3.
Дано: Решение:
 С(KOH) = 1,5·10-2 моль·дм-3 KOH « K+ + OH-, т.к. a = 1, то
С(KOH) = 1,5·10-2 моль·дм-3 KOH « K+ + OH-, т.к. a = 1, то
 [OH-] = [KOH] = 1,5·10-2 моль·дм-3
[OH-] = [KOH] = 1,5·10-2 моль·дм-3
рН -? pOH = -lg[OH-]
pOH = -lg1,5·10-2 = 1,82
pH + pOH = 14 Þ pH = 14 – pOH
pH = 14 – 1,82 = 12,18.
Ответ: pH = 12,18.
Задача №3: pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и [OH-] в желудочном соке.
Дано: Решение:
 pH = 1,65 pH = -lg [H+]
pH = 1,65 pH = -lg [H+]
 lg [H+] = -pH Þ [H+] = 10-pH
lg [H+] = -pH Þ [H+] = 10-pH
[H+] - ? [H+] = 10-1,65 = 0,0224 моль·дм-3 = 2,24·10-2 моль·дм-3
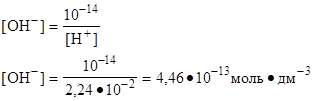 |
[OH-] - ? [H+] · [OH-] = 10-14
Ответ: [H+] = 2,24·10-2 моль·дм-3
[OH-] = 4,46·10-13 моль·дм-3 .
III. Решить задачи:
1. Рассчитать рН и рОН слюны, если концентрация ионов водорода в ней составляет 1,78·10-7 моль·дм-3. Ответ: рН = 6,75; рОН = 7,25.
2. Физиологическое значение рН крови 7,36. Определить концентрацию ионов [H+] и [OH-] в крови.
Ответ: [H+] = 4,37 · 10-8 моль·дм-3
[OH-] = 2,29 · 10-7 моль·дм-3.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 101-107.
2. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С. 142-146.
3. Материалы лекций.
ЗАДАНИЕ №10
РУБЕЖНАЯ КОНТРОЛЬНАЯ РАБОТА
Подготовиться к ответам на вопросы по следующим разделам курса общей химии:
I. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
1. Термодинамика. Основные понятия и термины. Система. Фаза. Классификация систем. Термодинамические параметры. Стандартные термодинамические параметры.
2. Термодинамические функции состояния системы. Внутренняя энергия. Первый закон термодинамики, формулировка, математическое выражение, философское значение, применение к биологическим системам.
3. Термодинамические функции состояния системы. Энтальпия. Энтропия. Энергия Гиббса. Химический потенциал.
4. Термохимия. Термохимические уравнения, их особенности. Закон Гесса. Энтальпии образования и сгорания. 1-ое и 2-ое следствия из закона Гесса, формулировки, математические выражения, примеры.
5. Понятия о коэффициенте калорийности пищи. Коэффициенты калорийности основных продуктов питания: белков, жиров и углеводов.
6. Второй закон термодинамики, его формулировки. Энтропия как критерий и энергия Гиббса как главный критерий возможности самопроизвольного протекания процессов.
7. Химическое равновесие, константа равновесия. Термодинамическая характеристика химического равновесия. Уравнение изотермы химической реакции, условия равновесия и направления обратимых химических реакций.
8. Принцип Ле-Шателье, зависимость направления обратимых химических реакций от термодинамических параметров.
9. Применение термодинамики к биологическим системам. Особенности организации живых систем. Энергия пищевых веществ (продуктов питания) как основной источник энергии для человеческого организма.
10. Термодинамическая характеристика пищевых веществ и продуктов жизнедеятельности. Стационарное состояние организма и механизмы его поддержания. Теорема Пригожина.
II. РАСТВОРЫ
1. Растворы. Классификация растворов. Способы выражения концентрации растворов.
2. Образование растворов. Термодинамика растворов. Влияние энтальпийного (DН) и энтропийного факторов (DS) на величину (DG) в процессе растворения веществ
3. Растворимость веществ. Влияние на растворимость природы компонентов и внешних факторов - температуры и давления.
4. Законы Генри и Дальтона. Горная болезнь. Эмболия. Кессонная болезнь.
5. Влияние на растворимость электролитов. Закон И.М. Сеченова, его значение в физиологии.
6. Электролиты. Степень диссоциации. Константа диссоциации.
7. Сильные электролиты. Состояние ионов в растворах сильных электролитов. Межионное взаимодействие. Понятие об активности, коэффициент активности.
8. Ионная сила, ее математическое выражение, значение в биологических системах.
9. Ионное произведение воды. Водородный показатель среды растворов, его значение в кислой, щелочной и нейтральной средах. Биологическая роль водородного показателя.
10. Протолитическая (протонная) теория кислот и оснований Бренстеда и Лоури. Протолиты. Показатель константы кислотности (рКа).
11. Электронная теория кислот и оснований Льюиса. Понятие о мягких и жестких кислотах и основаниях.
12. Гидролиз. Виды гидролиза солей, привести примеры.
13. Количественные характеристики процесса гидролиза: константа и степень гидролиза. Биологическое значение процессов гидролиза.
14. Коллигативные свойства растворов. Осмос. Осмотическое давление. Биологическое значение осмоса.
III. ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
1. Титриметрический анализ, его принципы и требования. Титрование. Фиксирование момента эквивалентности. Количественные расчеты в титриметрическом анализе.
2. Сущность метода нейтрализации. Ацидиметрия. Алкалиметрия. Применение метода в клинических и санитарно-гигиенических анализах.
3. Индикаторы метода нейтрализации. Ионная теория действия индикаторов Оствальда.
4. Зона переходной окраски индикаторов. Показатель титрования индикаторов (рТ). Выбор индикаторов с учетом значений рТ, привести примеры.
5. Оксидиметрия: сущность метода, классификация, способы фиксирования момента эквивалентности. Принцип расчета молярной массы эквивалентов окислителей и восстановителей.
6. Перманганатометрия: принцип метода, фиксирование момента эквивалентности, применение метода в медицине.
7. Окислительное действие перманганата калия в кислой, щелочной и нейтральной средах.
8. Приготовление раствора перманганата калия – титранта, условия его хранения.
IV. ТИПОВЫЕ ЗАДАЧИ
1. Способы выражения концентрации растворов – Д.З. №1.
2. Введение в титриметрический анализ – Д.З. №2.
3. Перманганатометрия – Д.З. №5.
4. Осмотическое давление растворов – Д.З. №8.
5. Элементы химической термодинамики – Д.З. № 6 и 7.
6. РН растворов – Д.З. №9.
ЛИТЕРАТУРА:
См. Д.З. № 1 – 9.
ЗАДАНИЕ №11
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. МЕТОД КОМПЛЕКСОНОМЕТРИИ.
I. Подготовить ответы на следующие вопросы:
1. Комплексные соединения. Строение комплексных соединений согласно теории А. Вернера (комплексообразователи, лиганды, координационные числа, внутренняя и внешняя сфера).
2. Заряд комплексного иона. Катионные, анионные, нейтральные комплексные соединения, их номенклатура. Примеры.
3. Устойчивость комплексных соединений. Константа нестойкости, уравнение изотермы.
4. Моно- и полидентатные лиганды. Хелаты. Комплексоны. Трилон «Б». Краун–эфиры.
5. Значение комплексных соединений в биологии и медицине.
II. Подготовиться к лабораторной работе «Определение общей жесткости воды комплексонометрическим методом».
III. Подготовиться к тестированному контролю по теме «Комплексные соединения». Разобрать решение типовых задач.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|