
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таблица 1. Динамика общего числа лейкоцитов и соотношения лимфоцитов и нейтрофилов в периферической крови мышей после воздействия векторного потенциала
Таблица 1. Динамика общего числа лейкоцитов и соотношения лимфоцитов и нейтрофилов в периферической крови мышей после воздействия векторного потенциала
Чтоб увеличить изображение, кликните по нему
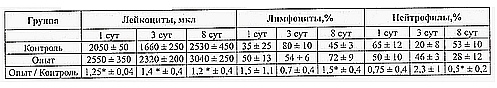
Примечание: *р < 0,05 опыт по отношению к контролю.
Количество лейкоцитов в 1 мкл крови и процентное содержание в ней лимфоцитов и нейтрофилов определялось с помощью микроскопа. Полученные результаты приведены в табл. 1, где указаны средние величины количества клеток в 1 мкл крови и относительные доли лимфоцитов и нейтрофилов у контрольных и опытных мышей через 1, 3 и 8 сут после воздействия векторного потенциала. Как видно из таблицы, количество лейкоцитов у мышей, подвергнутых вариации векторного потенциала, во все периоды регистрации достоверно превышало таковое у мышей контрольной группы. Через восемь суток у мышей опытной группы количество нейтрофилов и их процентное содержание достоверно снижалось, а процентное содержание лимфоцитов достоверно увеличивалось.
Поглотительная функция перитонеальных макрофагов. В комплексную оценку фагоцитарного процесса входит изучение стадии поглощения. В эксперименте наблюдение за поглощением макрофагами введенных в клеточную суспензию микробов Staphillococcusaureus показало, что процент макрофагов, поглотивших микробы, после однократного 30-минутного воздействия векторного потенциала увеличился с 30% на первые сутки до 45% к восьмым). В контрольной группе фагоцитоз составлял 20 и 27% соответственно. Среднее число микробов, поглощенных одним макрофагом, у опытных мышей также имело тенденцию к повышению, что может быть обусловлено как возрастанием количества лейкоцитов (и нейтрофилов) в крови подопытных животных по отношению к контролю (см. табл. 1), так и изменением экспрессии рецепторных молекул на макрофагах при воздействии векторного потенциала.
Адгезия макрофагов на пластик. Адгезия фагоцитирующих клеток на пластик определялась спектрофотометрически стандартным методом [16]. Принцип метода состоит в: фиксации фагоцитирующих клеток на поверхности лунок пластикового 96-луночного планшета в течение 30 — 60 мин при 37°С (1), фиксации прилипших к пластику макрофагов 96% этанолом в течение 30 мин (2), 30-минутном окрашивании клеточного монослоя по Романовскому-Гимза (3), растворении поглощенного красителя пропиловым спиртом, подкисленным 0,04 М НС1 (4), измерении оптической плотности раствора на длине волны 650 нм (5), измерении количества и процента адгезированных клеток по стандартной калибровочной кривой (6).
Уже через одни сутки после воздействия векторного потенциала индекс стимуляции (отношение индуцированной и спонтанной адгезии макрофагов) нарастал до 1,77 при контрольном значении — 1,35. К восьмым суткам индекс стимуляции снижался до 1,1 в опытной группе и до 0,7 — в контрольной, что могло бы быть обусловлено повышением уровня экспрессии поверхностных рецепторов (селектинов и интегринов), опосредующих адгезивные свойства макрофагов под воздействием векторного потенциала через одни сутки с последующей отменой эффекта.
Дегрануляция. Процесс дегрануляции заключается в слиянии фагосомы-вакуоли, содержащей объект фагоцитоза, с лизосомами с образованием фаголизосомы, в которой происходит киллинг и разрушение захваченной частицы. Оценка дегрануляции осуществлялась по способности миелопероксидазы (МПО) — фермента первичных гранул к окислению ряда субстратов в присутствии перекиси водорода [16]. Индексы стимуляции (отношение индуцированной активности МПО к спонтанной) вычислялись в контрольной и опытной группах мышей через одни, трое и восемь суток после воздействия векторного потенциала.
Измерения показали, что через одни и трое суток индекс стимуляции активности МПО под действием векторного потенциала имел тенденцию к повышению, составляя в опыте 0,9 (в контроле — 0,7), к восьмым суткам этот эффект отменялся.
Кислород независимый киллинг. Катионные белки. В отсутствие кислорода бактерицидной системой фагоцитирующей клетки, способной к киллингу поглощенных бактериальных агентов, является система катионных белков, определяемых спектрофотометрически стандартным методом [16]. Воздействие векторного потенциала не оказывало достоверных изменений концентрации катионных белков в макрофагах ни в спонтанном, ни в индуцированном вариантах при однократном 30-минутном воздействии.
Оценка кислородного метаболизма макрофагов. Продукцию активных форм кислорода регистрировали хемилюминесцентным методом с помощью хемилюминометра LKB 1251 (Финляндия) в комплекте с компьютером IBM-PCпри температуре счетной камеры 37°С. Люминолзависимая хемилюминесценция (ЛХМ) локализована, как известно, в зеленой области спектра и имеет широкий максимум в районе λ= 425 нм [17]. Количество фотонов этого спектрального диапазона, попадавших на счетчик каждые 5 секунд наблюдения, фиксировалось, как мера интенсивности фагоцитарной реакции, использующей АФК. Как и в вышеописанных опытах, индуктором фагоцитарной реакции служил опсонизированный зимозан, внутрибрюшинно вводимый мышам за 6 часов до их забоя. В качестве усилителя свечения использовали люминол (5-амино-2,3- дигидро-1,4-фталазиндион) в конечной концентрации 24,5 мкМ.
Типичная кинетика ЛХЛ характеризуется начальным нарастанием интенсивности свечения и последующим ее спадом. ЛХЛ оценивали по максимальной (по времени) величине сигнала ЛХЛ (М) и светосумме хемилюминесцентного ответа макрофагов за период времени / от момента добавления люминола (t = 0) до окончания регистрации свечения (t = 40 мин) (S).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|