
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
материалы Международной научно-практической конференции «Современные методы диагностики и электромагнитная терапия в коррекции здоровья», г.Киев, 6-7 апреля 2013г.)
Векторный потенциал – не энергетический электродинамический фактор, влияющий на биологические процессы (материалы международной научно-практической конференции)
(материалы Международной научно-практической конференции «Современные методы диагностики и электромагнитная терапия в коррекции здоровья», г.Киев, 6-7 апреля 2013г.)
Трухан Эдуард Михайлович — профессор, доктор физико-математических наук, зав. кафедрой биофизики и экологии московского физико-технического института, центр теоретических проблем физико-химической фармакологии РАН, Москва,
Полетаев А.И. — вице-президент, профессор, доктор физико-математических наук, председатель научного совета международной ассоциации комплементарной медицины, главный специалист центра физико-химических проблем фармакологии Российской академии, доктор физико-математических наук, г.Москва, Россия,
Апельцин Виктор Филиппович — канд. физ.-мат. наук, доцент кафедры «Вычислительная математика и математическая физика» Московского государственного технического университа им. Р.Э.Баумана, Москва
Влияние электромагнитных факторов на биологические системы и, в частности, на организм человека представляет собой классический предмет биофизики, физиологии и других разделов теоретических и прикладных медико-биологических исследований. Вопрос о воздействии возмущений магнитосферы Земли на состояние живых организмов также давно поднимался в литературе [1]. Количество отечественных и зарубежных научных публикаций в этом научном направлении исчисляется многими тысячами.
Многие годы ведутся исследования влияния на биологические объекты электромагнитных факторов в различных частотных диапазонах – от постоянных полей до гамма-излучения. Отдельное направление исследований – воздействие низкоинтенсивного излучения лазеров видимого и ближнего ИК- диапазона, слабые СВЧ- и КВЧ-излучений, малые и сверхмалые магнитные поля. В работе [2] был добавлен безроторный (т.е. лишенный магнитного поля) статический векторный потенциал.
Векторный потенциал А, связанный с индукцией магнитного поля В соотношением rotA= В, широко используется в физике как математическая величина, облегчающая расчет пространственного распределения магнитного поля, создаваемого системой макроскопических токов или намагниченных материалов (т.е. микроскопических токов) [3]. Однако другое его свойство, а именно способность изменять фазы волновых функций заряженных частиц (даже при В = 0), менее известно, но в некоторых случаях может иметь большое значение для перемещения зарядов [4].
Между тем векторный потенциал всегда сопровождает электрические токи и простирается на значительные расстояния от области их локализации, убывая с расстоянием r как r-1, в отличие от магнитной индукции, убывающей как r-2. Поэтому биосфера нашей планеты всегда подвержена воздействию векторного потенциала земного, лунного и солнечного происхождения. «Роторная» (вихревая) часть его мала и наблюдается в виде относительно постоянного магнитного поля и его пульсаций в виде «магнитных бурь». Основная же «безроторная» часть векторного потенциала остается нерегистрируемой. Она принципиально неустранима, но для исследовательских целей ее можно изменить в конкретных лабораторных условиях, добавив к ней дополнительный векторный потенциал, созданный специальными техническими средствами. Процессы, вызванные в объекте исследования этой вариацией векторного потенциала, могут быть и стали предметом экспериментального исследования [5-8].
Величина векторного потенциала А входит в классические уравнения электродинамики (уравнения Максвелла-Хевисайда), но до конца 50-х годов считалась лишь удобной математической функцией, упрощающей теоретические расчёты. В 1959 году в работе [9] было сформулировано принципиально другое отношение к этому параметру – как к физическому фактору, оказывающему прямое влияние на волновые функции электронов. Экспериментальная проверка этого положения продлилась до 1986 года. В 1989 году была опубликована популярная статья [10], в которой указывалось на потенциальную значимость векторного потенциала в физике вообще и для развития микроэлектроники, в частности.
В последние несколько лет было экспериментально показано прямое влияние векторного потенциала на биологические объекты при отсутствии электрического и магнитных полей [2,5-7].
В контексте нашей проблемы нас интересует в первую очередь случай создания безроторного векторного потенциала, т.е. потенциала, свободного от магнитного поля в области расположения объекта воздействия. Геометрия устройства, создающего локализованное магнитное поле, хорошо известна, это соленоид, свернутый в тор, или намагниченный стержень, замкнутый в «бублик» (рис. 1).
Магнитное поле сосредоточено внутри тела «бублика», снаружи же от него лишь безроторный векторный потенциал. Линии векторного потенциала охватывают соленоид или магнитный стержень, создавая в центре кольца и вблизи от него область относительно однородного поля. Величину потенциала в функции координат можно найти, если воспользоваться подобием выражения А через В и выражения В через j (j – ток в объекте) [11]. Так, на оси тонкого кольца с магнитной индукцией В для векторного потенциала получим [3]:
A = ϕr2[2(r2 = z2)]3/2, ϕ = BS
r- радиус тора,
z- расстояние от плоскости кольца,
S- площадь поперечного сечения тела тора.
При r = 3 см, S=2см2, В = 150 мТл, z = 0 (в центре плоскости кольца) А = 3,56•10-4 Тл•м. При удалении от центра по оси на расстояние z = 5 см А = 4,9•10-5 Тл•м, т.е. такое устройство обеспечивает необходимую величину векторного потенциала. При этом во всем пространстве, окружающем тор, магнитное поле, создаваемое устройством, отсутствует! [5]
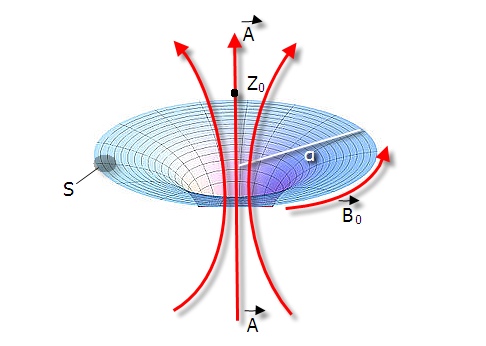
Рис.1. Способ создания безроторного векторного потенциала. Линии вокруг тора — направление векторного потенциала.
Для того, чтобы гарантировать чистоту условий эксперимента в работе [2] «бублик», создающий векторный потенциал А, дополнительно помещали в магнитный экран, который блокировал рассеянное магнитное поле в окружающем пространстве. Напряженность рассеянного поля не превышала величины магнитного поля Земли — 50мкТл. Для векторного потенциала А магнитный экран не является препятствием [12].
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали воду высокой очистки («Миллипор», удельное сопротивление 18,2 МОм•см. при 20°С) с добавкой при необходимости солевых компонентов, в отдельных случаях — кипяченую или отстоянную водопроводную воду. При приготовлении физиологического раствора (0,9% раствор NaCl) использовали NaCI квалификации «чда» (Россия).
В качестве лабораторного источника векторного потенциала использовали специальное устройство, описанное в [2,5,6], Устройство состоит из особым образом расположенных самарий-кобальтовых магнитов и создает замкнутый локализованный поток магнитной индукции, вне которого имеется область «безроторного» векторного потенциала, теоретически лишенная магнитного поля. Расчетная максимальная величина векторного потенциала, создаваемого в этой области, отлична от нуля и составляет 3,5 10-4 Тл•м. Остаточное магнитное поле рассеяния, проникающее в эту область, составляет величину в несколько долей мТл.
В дополнительных контрольных опытах устройство помещали в специальный стальной экран, ослабляющий остаточное магнитное поле в десятки раз. Эти опыты показали, что остаточное поле не влияет на получаемые результаты. Так как результирующая величина векторного потенциала в объеме испытуемого образца является суперпозицией исходного векторного потенциала природного и антропогенного происхождения и нашим лабораторным источником, то в экспериментах всегда использовалась одинаковая (а именно, вертикальная) ориентация дополнительного векторного потенциала. Наблюдаемый эффект являлся в сущности реакцией объекта на вариацию векторного потенциала.
В опытах применяли два типа обработки водной пробы: стационарный и кинетический. В первом случае пробу воды в стеклянной колбе выдерживали в течение 1 ч непосредственно над источником векторного потенциала. Расчетная величина дополнительного векторного потенциала при этом лежала в пределах (0,5-1)10-4 Тл•м. Во втором случае свободно текущую струю воды в стеклянной трубке пропускали через область максимума дополнительного векторного потенциала. Общее время пребывания пробы в этой области составляло 40-50 мс.
Регистрация спектров оптического поглощения производилась с помощью двулучевого автоматизированного спектрофотометра SpecordM-400 (Германия), позволяющего автоматически проводить многократные повторы измерений дифференциальных спектров поглощения в видимой и ультрафиолетовой областях cпектра.
Для определения подвижности простейших гидробионтов в воде использовались инфузории спиростомы Spirostomusamhiquum, культивируемые в лабораторных условиях. Подвижность инфузорий определяли визуально с использованием микроскопа МБС-9. Индекс двигательной активности вычисляли как число пересечений инфузориями, свободно плавающими в пробе воды, маркерной линии за 5 мин непрерывного наблюдения. Этот тест часто применяется в экологическом мониторинге водных объектов.
В эксперименте с потреблением воды использовали мышей линии СВА (11 особей), находившихся в общей клетке с двумя поилками. Специальная конструкция поилок позволяла определять количество воды, выпитой за 1—2 суток, по уменьшению ее объема в поилках. Использовали отстоянную водопроводную воду.
Для опытов с дрожжами (регидратированная культура Saccharomycescerevisiae) была изготовлена специальная установка, позволяющая с высокой точностью измерять скорость газовыделсния (СО2) дрожжами при добавлении к ним сахарозы по изменению объема газа над суспензией дрожжей, изолированного от атмосферы водным затвором. Суспензию дрожжей готовили на кипяченой водопроводной воде. Сахарозу и дрожжи растворяли в воде, имеющей температуру 35°С. Концентрация компонентов в рабочей суспензии составляла 0,8 г сахарозы и 0,4 г дрожжей в 100 мл воды. Измерения скорости выделения СО2 начинали через полчаса после приготовления суспензии и проводили при комнатной температуре. Контрольная и опытная колбы имели объем по 50 мл и содержали по 30 мл рабочей суспензии.
Через несколько минут после заполнения рабочих сосудов и изолирования объемов газовой среды над суспензией в системе устанавливался стационарный режим брожения, скорость которого определяли по изменению замкнутых объемов при постоянном давлении. Были реализованы две схемы опытов. В одной из них изучали действие векторного потенциала на готовую суспензию непосредственно в рабочем сосуде. В этом случае концентрацию компонентов суспензии в колбах сразу устанавливали на указанных выше уровнях. Во второй схеме воздействию векторного потенциала подвергали только воду, которая затем добавлялась к суспензии. При этом в обе рабочие колбы заливали по 15 мл суспензии удвоенной концентрации, а перед измерением в колбы добавляли по 15 мл чистой или обработанной векторным потенциалом воды соответственно.
Определение концентрации мономерного кремнезема в воде проводили по методике Айлера [13]. Для этого готовили специальный тестирующий раствор молибденовой кислоты (0,57 М МоО42- и 1,2 н NH4+). 100 мл этого раствора и 200 мл 1,5 н раствора H2SO4 добавляли к 500 мл чистой воды («Миллипор»). Полученная реакционная смесь при рН 1,2 имеет концентрацию 0,071 ММоО4-2, 0,148н NH4+ и 0,375 н SO42-. Все реагенты имели квалификацию «чда» (Россия). К 40 мл реакционной смеси в 50-миллилитровой колбе добавляли 10 мл испытуемой водной пробы. В другой такой же колбе к реакционной смеси добавляли контрольную пробу воды и с помощью диф- ференциального спектрофотометра измеряли разницу в поглощении двух образцов на длине волны 410 нм. Эта разница соответствует разнице в концентрациях мономера кремнезема в испытуемой и контрольной пробах [13].
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Известным показателем биологических свойств воды является ее органолептические (вкусовые) свойства. Однако оценка вкусовых качеств весьма субъективна и не позволяет получить надежную количественную характеристику пробы. В нашем случае практически все добровольные непрофессиональные эксперты в слепых выборках проб правильно отличали обработанную воду от контрольной, но мы не сочли эти результаты показательными для важных в научном отношении выводов. Для объективизации изменения свойств воды в результате се активации векторным потенциалом были использованы более надежные объективные количественные показатели свойств воды: подвижность инфузорий-спиростом в воде и объем воды, выпиваемой группой мышей за определенный период.
Подвижность инфузорий. В работе [2] описано изменение индекса двигательной активности спиростом при экспонировании их в поле векторного потенциала. В данной работе экспонированию подвергали опытную порцию чистой воды, которую затем в соотношении 1:1 добавляли к воде с инкубируемыми инфузориями. Обработку воды проводили в кинетическом режиме. В контрольных экспериментах к инфузориям добавляли такой же объем необработанной воды. Измерения проводили в течение нескольких дней в феврале 2004 года в дневное время. Каждый день наблюдения повторялись по несколько раз. Результаты измерений индекса двигательной активности приведены на рис. 2. Отчетливо видно стимулирующее действие «векторно потснциированной» воды на подвижность инфузорий. Не было ни одного измерения, в котором результат воздействия был бы иным.
Чтоб увеличить изображение, кликните по нему
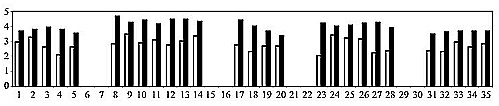
Рис. 2. Индекс двигательной активности (ИДА) спиростом при обработке воды векторным потенциалом. Светлые столбики — контрольный опыт, темные — опыт с обработанной водой.
Потребление воды мышами. Опыты с мышами проводили совместно с сотрудниками НИИ трансплантологии и искусственных органов. Эти результаты кратко изложены в работе [14] и в более полном виде в работе [6].
В первой серии многодневных наблюдений мышам предлагали питьевую воду в двух идентичных поилках, расположенных в разных углах клетки. Под одной из поилок был скрытно расположен источник векторного потенциала. Результаты измерений объема воды, выпиваемой из поилок за каждый период наблюдения, отчетливо свидетельствуют о предпочтении мышами воды из поилки, расположенной над источником векторного потенциала (рис. 3). Чтобы исключить влияние на результат возможного привлекающего влияния векторного потенциала на самих мышей, что могло увеличить частоту потребления воды из соответствующей поилки, постановка опыта была изменена.
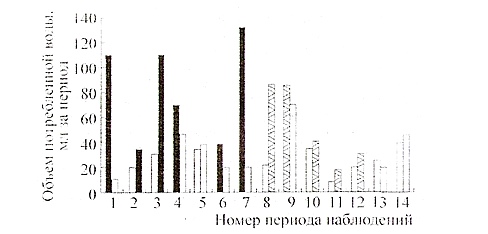
Рис. 3. Доля воды из разных поилок в рационе мышей. По горизонтальной оси — периоды наблюдения, по вертикальной оси — объем воды (в мл), выпитой из поилок: серые столбики — контроль, темные столбики — под поилкой находился источник векторного потенциала, полосатые столбики — в поилке находилась вода, предварительно обработанная векторным потенциалом. В периоды 5, 13, 14 обработка воды не производилась.
Во второй серии наблюдений источник векторного потенциала был удален, а в одну из поилок наливали воду, активированную векторным потенциалом в стационарных условиях в течение часа вне клетки. Воду в поилках заменяли каждый день. Результаты, приведенные на рис. 3, подтверждают предпочтение мышами обработанной воды. Смена поилки, в которую наливали обработанную воду, легко определялась мышами. За все время наблюдения не было ни одного результата, который бы противоречил выводу о явном предпочтении мышами воды, экспонированной в поле векторного потенциала. Интересно отметить, что разница в количестве выпиваемой воды за последующий период наблюдения возрастала, если источник векторного потенциала оставался на том же месте (наблюдения 3 и 7) и снижалась при смене его положения (наблюдения 2 и 4). Похожую картину наблюдали и при внесении воды, обработанной вне клеток (смена поилок в периоды 9 и 10). Вероятно, в каждый период наблюдения у мышей сохранялась память о предпочтительной поилке от предыдущего периода, и лишь «распробовав» воду и обнаружив подмену, мыши переключались на другую поилку.
Скорость брожения в суспензии дрожжей
Контрольные опыты показали практически полную идентичность кинетики брожения в обеих колбах при отсутствии вариации векторного потенциала. Подведение под одну из колб («опытную») источника векторного потенциала практически сразу же оказывало эффект значительного замедления скорости газовыделения в этой колбе (рис. 4). Эта пониженная скорость сохранялась в течение всего времени присутствия источника векторного потенциала (1 ч) и после устранения источника во весь период наблюдения. Аналогичный эффект ингибирующего типа наблюдался и в опытах, проводившихся по второй схеме, когда вода подвергалась предварительному воздействию векторного потенциала в кинетическом режиме (рис. 4).
Чтобы отделить наблюдаемый эффект от возможного воздействия на объект исследования остаточного магнитного поля величиной в несколько десятков гаусс, создаваемого источником векторного потенциала, были проведены дополнительные измерения. Вместо специального источника векторного потенциала под «опытную» колбу был подведен постоянный магнит, создающий в объеме колбы магнитное поле около 40 Гс, но значительно (в пять — шесть раз) меньшую расчетную величину векторного потенциала, чем от нашего источника «безроторного» векторного потенциала. Результаты измерения в сильно растянутом масштабе приведены на рис. 5.

Рис. 4. Изменения скорости газовыделения в суспензии дрожжей. Повторные контрольные опыты без внешнего воздействия (квадраты). Отклонение от контроля при воздействии источника векторного потенциала, подведенного под опытную колбу на 20-й минуте опыта (треугольники). Отклонение от контроля при внесении в опытную колбу перед началом измерения воды, активированной векторным потенциалом в кинетическом режиме (крестики).
Аналогичный результат был получен и при предварительной магнитной обработке воды в кинетическом режиме с помощью промышленного устройства для «омагничивания» воды (рис. 5). Отсутствие наблюдаемого воздействия на скорость брожения при данной постановке опытов говорит о том, что эффект действия специального источника векторного потенциала, представленный на рис. 4, коррелирует с величиной векторного потенциала, а не магнитного поля.

Рис. 5. Влияние постоянного магнитного поля (около 40 Гс) (квадраты) и «омагничивания» воды (треугольники) на cуспензию дрожжей. Масштаб по вертикали сильно растянут по отношению к рис. 4
Оптическая плотность воды. Поглощение «чистой» воды, находящейся в равновесии с окружающей газовой атмосферой, в УФ-диапазоне сосредоточено в области λ≤220 нм. На рис. 6 приведено изменение спектра поглощения физиологического раствора после его 20-минутной экспозиции в поле векторного потенциала. Отчетливо видно уменьшение оптической плотности обработанной воды в области λ.
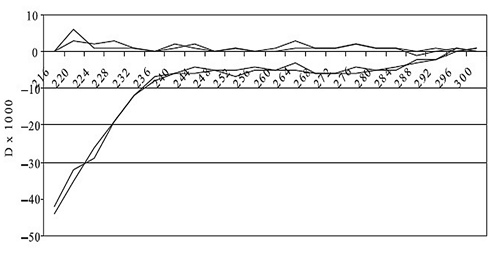
Рис. 6. Дифференциальный спектр оптического поглощения двух идентичных кювет с физраствором. Две верхние кривые — повторы контрольной записи дифференциального спектра до воздействия источника векторного потенциала. Две нижние кривые — повторные записи после 20-минутной экспозиции одной из кювет в поле векторного потенциала.
Другое свидетельство изменений физико-химических свойств воды получено при наблюдении за состоянием кремнезема в воде. Кремнезем (различные формы SiO2) всегда присутствует в водной среде и в живых тканях [13]. Так, речная вода содержит (5-35) — 10-4% кремнезема, и даже в водяном паре при температуре 400°С его остается около 10-5% [13]. При этом кремнезем может быть в двух формах: мономерной (это Si(OH)4) или полимерной, образующей гель. В обычной воде доля полимерной формы составляет 5-10%; от его общего количества. В крови человека концентрация кремнезема составляет 0,0008%, причем по некоторым данным [15] его концентрация в плазме крови больше зависит от атмосферных условий, чем от других факторов жизни.
Поэтому, полагая, что вариации векторного потенциала в наших экспериментах отчасти имитируют параметры метеоусловий, можно было ожидать изменения состояния кремнезема в пробе воды при вариации векторного потенциала. Действительно, измерение концентрации мономера кремнезема методом Айлера выявило снижение оптической плотности на длине волны 410нм у опытной пробы по отношению к контрольной на ΔD= 0,005 ± 0,002 (при достоверности 95%) при контрольном значении D = 0,077 ± 0,001. Этот результат соответствует уменьшению доли мономерной формы в обработанной воде на 5-6% от ее исходной величины. Если принять в соответствии с [13]|, что в обычной воде в полимерной форме содержится 5-10% всего кремнезема, то полученное уменьшение мономерной формы означает увеличение доли полимерной на 4-5% от общего количества кремнезема, т.е. в 1,5-2 раза. Более обстоятельные эксперименты с кремнеземом опи- саны в работе [7].
Роль примеси кремнезема в воде вызывает интригующий интерес [13,15], но пока мало изучена. В данный момент преждевременно обсуждать физико-химический смысл обнаруженного эффекта. Можно лишь высказать предположение о том, что столь существенное увеличение доли полимерной формы кремнезема вызвано локальным защелачиванием водной фазы в окрестности вкраплений кремнезема [15] или структуризацией воды, способствующей сдвигу распределения кремнезема в сторону его полимерной формы. И то, и другое свидетельствует об изменении физико-химического состояния воды при вариации векторного потенциала.
Исследование моноцитарно-макрофагальной активности клеток мышей [6]. Объектом исследования служила иммунная система лабораторных мышей линии СВА, подвергавшихся однократной получасовой экспозиции в поле векторного потенциала. В данном сообщении приводятся результаты исследования изменения параметров фагоцитарной функции перитонеальных макрофагов/нейтрофилов мышей.
Девять подопытных мышей поочередно выдерживали по 30 минут в стеклянном стаканчике в области максимума векторного потенциала в центральной плоскости на оси тора. Девять контрольных мышей аналогично выдерживали в таких же стаканчиках в течение такого же времени вне тора на расстоянии 50 см от него. Эта процедура проводилась в подвальном помещении вивария при комнатной температуре и электрическом освещении. Контрольные и опытные животные после обработки помещались в две одинаковые рядом расположенные клетки размером 30 х 30 см и содержались в аналогичных стандартных условиях вивария, получая полноценное сбалансированное питание. Измерения проводили через одни, трое и восемь суток после экспозиции. В день обследования по три мыши из каждой группы перемещали в лабораторию, где им внутрибрюшинно вводили зимозан для накопления перитонеальных макрофагов в брюшной полости. Через 6 ч животных забивали. В периферической крови определяли содержание лейкоцитов и соотношение в них лимфоцитов и нейтрофилов. Перитонеальную жидкость использовали для комплексной оценки функциональной активности макрофагов на разных стадиях фаго- цитоза: адгезии, поглощения микробных агентов, их дегрануляции, образования активных форм кислорода (АФК), кислородного и некислородного киллинга. Оценивали фагоцитарную активность макрофагов опытных и контрольных мышей как спонтанную (без антигенной нагрузки), так и индуцированную (при стимуляции микробным антигеном в течение 30 мин при 37°С до постановки реакций). Опыты проводились трижды с использованием стандартных методов [16]. Статистическую обработку проводили с помощью компьютерной программы Excel'(Microsoft, США).
Общий анализ периферической крови. Одной из основных характеристик иммунного потенциала организма является количество лейкоцитов в крови, состав которых гетерогенен. Нейтрофилы и моноциты — фагоцитирующие клетки крови — являются первой линией защиты организма от чужеродных факторов. Оценка их доли в составе лейкоцитарной массы — основной показатель фагоцитарной потенции.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|