
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПОНЯТИЕ «ДОЛЯ» И ЕГО ПРИМЕНЕНИЕ В ХИМИИ
ПОНЯТИЕ «ДОЛЯ» И ЕГО ПРИМЕНЕНИЕ В ХИМИИ
Доля – безразмерная величина, она всегда меньше единицы. Чаще долю выражают в процентах, т.е. умножают е ё на 100%.
Массовая доля химического элемента в сложном веществе :
ω (Х)= 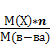 (4)
(4)
где ω(Х) – массовая доля элемента Х;
М(Х) – молярная масса атомов элемента Х;
n - число молей атомов элемента Х в моле вещества;
М(в-ва) – молярная масса вещества.
Понятие «доля» применимо не только к содержанию элемента в сложном веществе, но и к смесям веществ. Различают массовую (ω) и объемную доли( 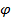 ) :
) :
-КОМПОНЕНТА в смеси:
ω (компонента)= 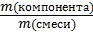 (·100%); (5)
(·100%); (5)
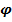 (компонента)=
(компонента)= 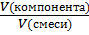 (·100%); (6)
(·100%); (6)
–ПРИМЕСИ ( частный случай доли компонента смеси):
ω (примесей)= 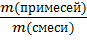 (· 100%); (7)
(· 100%); (7)
-ВЫХОДА продукта реакции по отношению к теоретически возможным массе или объему:
W вых = 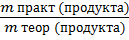 ( · 100%); (8)
( · 100%); (8)
W вых = 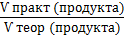 ( · 100%). (10)
( · 100%). (10)
Молярная концентрация ( «молярность») – это отношение количества растворенного вещества к объему раствора, моль/л :
См = 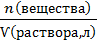 ; См =
; См = 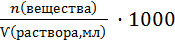 (11)
(11)
2) Основные законы химии:
Закон сохранения массы ( М.В.Ломоносов, 1748г.):
«Масса веществ, вступивших в реакцию, равна массе продуктов» .
Закон Авогадро ( А. Авогадро, 1811г.):
« В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул».
Из закона Авогадро вытекают два следствия:
1. Один моль любого газа при одинаковых условиях занимает один и тот же объем. Этот объем, называемый молярным, при нормальных условиях ( давление Ро = 101325 Па и абсолютная температура То = 273,15 К ), равен 22,4 л:
Ѵм = 22,4 л/моль или 22,4 м3/кмоль
2. Массы двух различных газов, занимающих одинаковые объемы при одинаковых условиях, относятся между собой, как их молярные массы.
Отношение масс двух газов, занимающих равные объемы при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой Д. Для расчета проще всего использовать молярные массы газов :
Д 2= 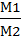 (12)
(12)
например ДН2 ( А) = 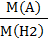 =
= 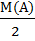 или Д возд (А) =
или Д возд (А) = 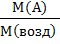 =
= 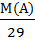 .
.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|