
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема «Основные понятия и законы химии»
Тема «Основные понятия и законы химии»
1) Основные понятия химии
Химический элемент- это совокупность атомов с одинаковым зарядом ядра.
Относительная атомная масса (Аr) химического элемента – это отношение абсолютной массы атома к 1/12 массы атома изотопа углерода 12С (где r – начальная буква английского слова - relative – относительный).
Относительной молекулярной массой Мr - называют отношение абсолютной массы молекулы к 1/12 массы атома изотопа углерода 12С.
Относительные массы по определению являются безразмерными величинами.
Таким образом, мерой относительных масс избрана 1/12 часть массы атома изотопа углерода 12С, которая называется атомной единицей массы (а.е.м.):
1 а.е.м.= 1/12 mА (С) = 1,66 · 10-24г = 1,66 · 10-27 кг
Моль – это единица количества вещества, содержащая столько же формульных единиц (атомов, молекул, ионов или др.), сколько атомов содержится в 12 г изотопа углерода 12С.
Моль – это количество вещества, масса которого, выраженная в граммах, численно равна относительной молекулярной массе.
Массу одного моля называют молярной массой и обозначают М:
М = Мr · 1 г/моль
То есть, значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента.
Единицами измерения молярной массы являются: г/моль или кг/кмоль.
Постоянная Авогадро - число атомов или молекул (или других формульных единиц), содержащихся в 1 моль вещества (Nа = 6,02 · 1023 моль-1), в 1 кмоль (Nа = 6,02 · 1026 кмоль-1),
в 1 ммоль (Nа = 6,02 · 1020 ммоль-1).
Количество вещества ( n или 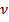 ) измеряется в молях, киломолях, или миллимолях и показывает :
) измеряется в молях, киломолях, или миллимолях и показывает :
1) отношение массы вещества к его молярной массе n = m/M; (1)
2) объема газа (н.у.) к его молярному объему n =V/VM ; (2)
3) числа молекул, атомов или формульных единиц к числу Авогадро n = N/NA (3)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|