
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж).
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж).
Определите теплоту образования С2Н5ОН(ж), зная, что ΔН реакции = -1366,87 кДж.
Стандартные теплоты (энтальпии) образования некоторых участников реакции, ∆Н0298:
ΔH0СO2 = -393,51 кДж/моль,
ΔH0H2O = -285,84 кДж/моль.
Задание 6. (5 баллов) Рассчитайте рН раствора, содержащего смесь азотной и хлорной кислот: С(HNO3) = 0,01 моль/дм3, С(HClO4) = 0,05 моль/дм3.

| Химия.10 класс. Вариант-1 |

| Химия.10 класс. Вариант- 5 |
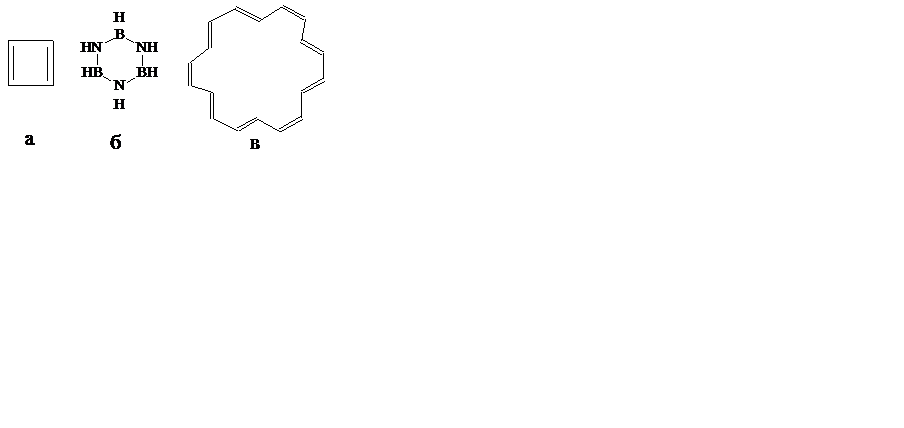
Задание 1. (5 баллов) Определите, к какому типу соединений (ароматические, неароматические, антиароматические) относятся следующие соединения. Свой выбор обоснуйте.
Задание 2. (5 баллов) Сравните, какие продукты будут находиться в растворе в результате элек- тролиза водного раствора нитрата меди (II) с инертными электродами в двух случаях: а) соль полностью подвергнута электролизу и после этого электроды сразу вынуты из раствора; б) соль полностью подвергнута электролизу, после этого в течение некоторого времени электроды остаются в растворе. Относительно второго случая рассмотрите две ситуации. Первая - электрический ток после полного электролиза соли отключен и вторая - электрический ток после полного электролиза соли не отключен.
Задание 3. (5 баллов) Смешали 1 моль оксида кальция, 2 моль карбида кальция и 3 моль фосфида кальция. Какой объём воды может вступить в реакцию с 16 г такой смеси? Сколько граммов гидроксида кальция при этом образуется?
Задание 4. (5 баллов) В 1901 г была впервые опубликована статья химика Виктора Гриньяра о применении магнийорганических соединений в синтезе кислот, спиртов и др. За выдающийся вклад В.Гриньяра в развитие органического синтеза, ему была присуждена Нобелевская премия по химии за 1912 г.
Предложите схему получения монодейтеробензола из хлорметана:
СН3Cl → С6Н5D
Задание 5. (5 баллов) Определите тепловой эффект реакции, протекающей по уравнению
СН3СООН (ж) + С2Н5ОН (ж) = СН3СООС2Н5 (ж) + Н2О (ж),
если теплоты сгорания участников реакции при 298 К равны:
∆cH°298,CH3COOH = -873,79 кДж/моль;
∆cH°298,C2H5OH = -1366,91 кДж/моль;
∆cH°298,CH3COOC2H5 = -2254,21 кДж/моль;
∆cH°298,H2O= 0 кДж/моль.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|