
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
FeO (к) + CO (г) = Fe (к) + CО2 (г), ΔH1 = -18,20 кДж;

| Химия.10 класс. Вариант-1 |
Задание 1. (5 баллов) К какому типу соединений (ароматические, неароматические, антиароматические) относятся циклонона-1,3,5,7-тетраен «а», а также ионы полученные отнятием от него Н+ «б», отнятием от него Н¯«в». Ответ обоснуйте.
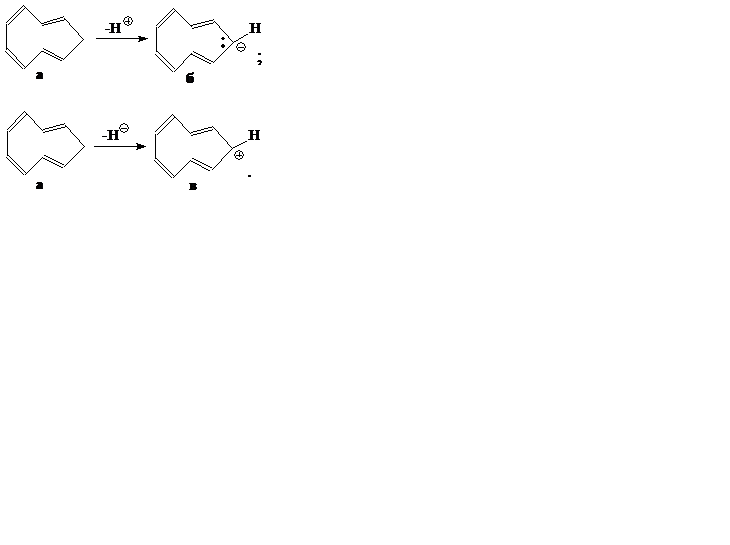
Задание 2. (5 баллов) При электролизе 16 г расплава химического соединения некоторого одновалентного элемента на аноде выделился водород количеством вещества 1 моль. Напишите уравнения реакций, протекающих во время электролиза и установите формулу вещества, взятого для электролиза.
Задание 3. (5 баллов) Образец метана (CH4) (н.у.) занимает объем, равный 4,48 л. Масса образца равна 3,4 г. Углерод в составе метана представлен двумя изотопами – 12C и 14C, водород – одним изотопом 1Н. Определите массовую долю (в процентах) 14СН4 в образце.
Задание 4. (5 баллов) В 1901 г была впервые опубликована статья французского химика Виктора Гриньяра о применении магнийорганических соединений в синтезе кислот, спиртов и углеводородов. Позже, за выдающийся вклад В. Гриньяра в развитие органического синтеза, ему была присуждена Нобелевская премия по химии за 1912 г.
Приведите схему получения 1-метилциклогексена. Все необходимые органические вещества получите из метана. Неорганические реагенты используйте любые.
Задание 5. (5 баллов) Реакция горения этилового спирта выражается термохимическим уравнением:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); ∆Н.
Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования С2Н5ОН(ж) равна +42,36 кДж, а теплоты образования участников равны: ∆Н С2Н5ОН(г)=-235,31 кДж/моль, ∆Н СО2(г)=-393,51 кДж/моль, ∆Н Н2О(ж) =-285,84 кДж/моль.
Задание 6. (5 баллов) Вычислите рН раствора, полученного при сливании 10 мл 0,008 М раствора гидроксида аммония и 20 мл 0,08 М раствора HCl.

| Химия.10 класс. Вариант-2 |
асс.
нт-2
Задание 1. (5 баллов) Определите, к какому типу соединений (ароматические, неароматические, антиароматические) относятся следующие соединения. Свой выбор обоснуйте.

Задание 2. (5 баллов) Увеличится или уменьшится масса цинковой пластинки, помещенной в растворы: а) NiSO4, б) AgNO3?
Стандартные электродные потенциалы металлов:
Ag+/Ag Ео = +0,80 В;
Ni2+/Ni Ео = -0,25 В;
Zn2+/Zn Ео = -0,76 В.
Задание 3. (5 баллов) К 30 л смеси, состоящей из аргона и этиламина, добавили 20 л бромоводорода, после чего плотность газовой смеси по воздуху стала равна 1,814. Вычислите объёмные доли газов в исходной смеси.
Задание 4. (5 баллов) Явление, когда вещество может существовать в виде нескольких изомерных форм, легко переходящих друг в друга и находящихся в динамическом равновесии, называют таутомерией. Переходящие друг в друга формы называют таутомерами, а их взаимный переход – таутомерным превращением. Флороглюцин (1,3,5-триоксибензол) – трёхатомный фенол. Изобразите формулу таутомера флороглюцина – «А» и напишите для «А» уравнение реакции гидрирования. Продукт назовите.

Задание 5. (5 баллов) Определите теплоту образования Са(ОН)2(тв) на основе реакций:
СаСО3=СаО+СО2+∆Н1;
СаО+Н2О=Са(ОН)2тв+∆Н2.
Термодинамические константы участников реакций:
∆Н0298(CaO)(к)= - 635,1 кДж/моль,
∆Н0298(СаСО3)(к)= -1206,0 кДж/моль,
∆Н0298(Са(ОН)2)(к)= -986,2 кДж/моль,
∆Н0298(СО2)(г)= -393,51 кДж/моль,
∆Н0298(Н2О)(ж)= -285,84 кДж/моль.
Задание 6. (5 баллов) Сплав содержит железо и никель. Какой из названных компонентов будет разрушаться при атмосферной коррозии? Приведите уравнения анодного и катодного процессов.
Электродные потенциалы металлов:
EFe2+/Fe = - 0,440 В;
ENi2+/Ni = - 0,250 В.

| Химия.10 класс. Вариант-3 |
Задание 1. (5 баллов) К какому типу соединений (ароматические, неароматические, антиароматические) относятся циклогептатриен-1,3,5 «а», а также ионы полученные отнятием от него Н+ «б», отнятием от него Н¯ «в». Ответ обоснуйте.
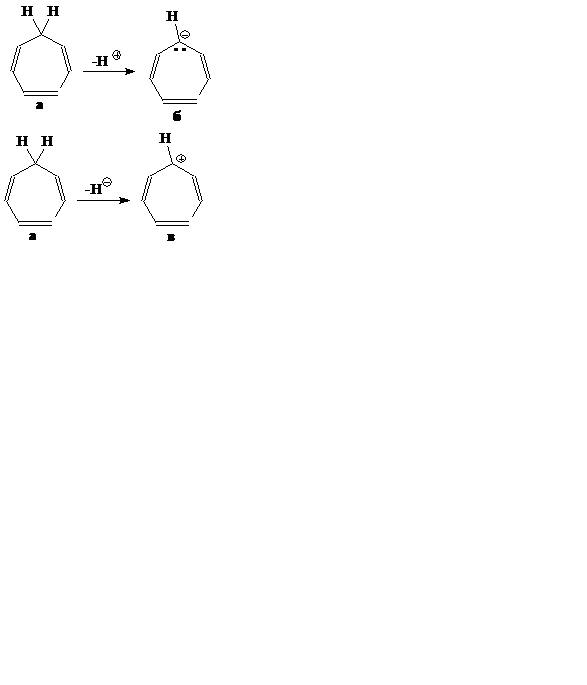
Задание 2. (5 баллов) Частичный электролиз раствора сульфата меди (II) прекратили в момент, когда масса раствора уменьшилась всего на 10 г. Определите массы продуктов, выделившихся на инертных электродах.
Задание 3. (5 баллов) Навеску неизвестного минерала массой 4,42 г прокалили. При этом его масса уменьшилась на 28, 05 %, частично за счет выделения 0,448 л (н.у.) газа с плотностью по воздуху примерно 1,52. Такую же навеску минерала растворили в серной кислоте, при этом выделилось 0,448 л (н.у.) того же газа. К образовавшемуся голубому раствору, содержащему только один вид катионов и анионов, прибавили избыток раствора сульфида натрия, образовавшийся осадок отфильтровали и прокалили без доступа воздуха. Его масса составила 3,82 г. Определите состав минерала.
Задание 4. (5 баллов) В 1901 г была впервые опубликована статья химика Виктора Гриньяра о применении магнийорганических соединений в синтезе органических соединений. Позже, за выдающийся вклад В.Гриньяра в развитие органического синтеза, ему была присуждена Нобелевская премия по химии за 1912 г.
Расшифруйте приведенную схему превращений. Укажите структурные формулы всех участников реакции.

Задание 5. (5 баллов) Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г), ΔH1 = -18,20 кДж;
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|