
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решения заданий. Одиннадцатый класс
Решения заданий
Одиннадцатый класс
Задача 11-1.
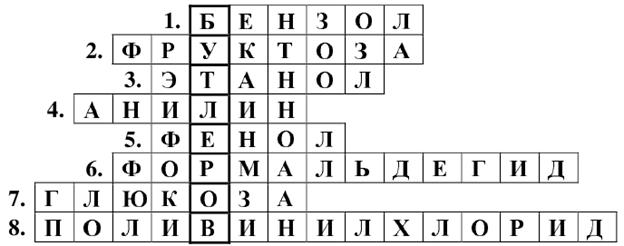
(4 балла)
а) 
б) 5C2H5OH + 4KMnO4+ 6H2SO4 → 5CH3COOH + 4MnSO4+ 2K2SO4+ 11H2O;
в) 
г) 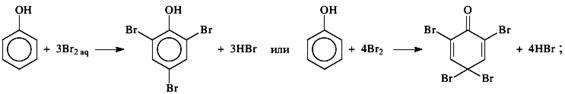
д)2HCOH + KOH → CH3OH + HCOOK;
е)C6H12O6+ [Ag(NH3)2]OH → C6H12O7(NH4) + Ag↓+ NH3 aq.
За каждое уравнение реакции по 1 баллу, за в) и д) по 2 балла.
Итого 12 баллов
Задача 11-2.
1. Общая формула гомологов ряда бензола СnH2n-6(n>5). Брутто-формулу С8H10 имеют 4 из них:
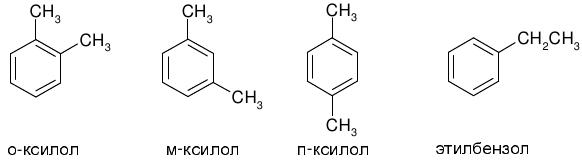
(5 баллов)
2. При окислении орто-, мета- и пара-диметилбензолов (ксилолов) образуются соответствующие фталевые кислоты:
5С6H4(CH3)2 + 12KMnO4 + 18H2SO4 = 5С6H4(CO2H)2 + 6K2SO4 + 12MnSO4 + 28H2O.
При окислении этилбензола образуются бензойная кислота и СО2:
5С6H5C2H5 + 12KMnO4 + 18H2SO4 = 5С6H5CO2H + 5СО2+ 6K2SO4 + 12MnSO4 + 28H2O.
(за уравнения реакций по 2 балла)
Из всех представленных в п.1 изомеров получить стирол (винилбензол) наиболее просто из этилбензола (Х) – в результате реакции дегидрирования на железо-хромовом катализаторе при нагревании до 600-650 °С:
С6H5C2H5  С6H5СН=СН2 + Н2 (1 балл)
С6H5СН=СН2 + Н2 (1 балл)
Стирол является одним из важнейших продуктов крупнотоннажного органического синтеза. Почти весь произведенный стирол используется при производстве пластмасс, как только на его основе (для получения полистирола), так и в качестве сополимера различных каучуков (бутадиен-стирольный каучук, стирол-акрилонитрильный каучук, акрилонитрил-бутадиен-стирольный каучук и др.). Из неорганических веществ и карбида кальция этилбензол можно получить по следующей схеме:
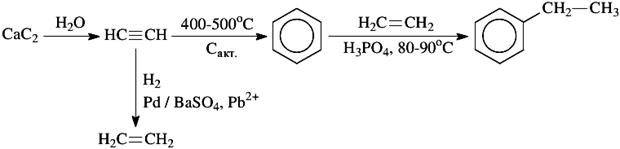
(5 баллов)
Итого 15 баллов
Задача 11-3.
Уравнения реакций:
а) Mn + Cl2 → MnCl2 (при нагревании);
б) MnO + 2HCl → MnCl2 + H2O;
в) MnO2 + 4HCl(конц) → MnCl2 + Cl2↑ + H2O (при нагревании);
г) 2KMnO4 + 16HCl(конц) → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O;
д) Mn + 2HCl → MnCl2 + H2↑;
е) MnСO3 + 2HCl → MnCl2 + H2O + CO2↑;
ж) MnSO4(раствор) + SrCl2(раствор) → MnCl2 + SrSO4↓ (при нагревании);
з) 2MnS + 3Cl2 → 2MnCl2 + S2Cl2↑;
и) Mn3(PO4)2 + 4HCl → 2MnCl2 + Mn(H2PO4)2;
д) Mn(ClO4)2(раствор) + 2KCl(раств.) → MnCl2 + KClO4↓
(10 баллов)
Названия соединений:
MnCl2 – хлорид марганца(II);
MnO – оксид марганца(II);
MnO2 – оксид марганца (IV);
KMnO4 – перманганат калия;
MnСO3 – карбонат марганца(II);
MnSO4 – сульфат марганца(II);
MnS – сульфид марганца(II);
Mn3(PO4)2 – ортофосфат марганца(II);
Mn(H2PO4)2 – дигидрофосфат марганца(II);
Mn(ClO4)2 – перхлорат марганца(II)
(5 баллов)
Итого 15 баллов
Задача 11-4.
Запишем уравнение ферментативного расщепления глюкозы без доступа воздуха: C6H12O6 = 2C2H5OH + ? Вычитая правую часть уравнения из левой, получаем C2O4, т.е. две молекулы CO2. Таким образом, полное уравнение ферментативного расщепления выглядит так: C6H12O6 = 2C2H5OH + 2CO2. Под пищевой энергетической ценностью вещества подразумевается энергия, полученная при расщеплении этого вещества до CO2 и H2O. Для CO2 эта величина, разумеется, равна нулю. Поэтому, энергия, которую получают микроорганизмы из 1 г глюкозы, равна разнице в энергетической ценности глюкозы и спирта с учетом количества моль: 3,9 ккал – 2×(1г/180г/моль)× 46г/моль×7,1ккал = 0,271 ккал.
За уравнение реакции или указание второго продукта ферментативного расщепления СO2 – 2 балла. За правильно составленный расчет и правильный с точностью ±10% численный ответ 270 калорий – 10 баллов. За правильно составленный расчет при неправильном численном ответе – 2 балла. За ответ без расчета – 0 баллов.
Итого 12 баллов
Задача 11-5.
Вначале определим соотношение количества атомов углерода и водорода в веществе Е***: (1,285л/22,4л/моль) : 2×(0,4426г/18г/моль) = 0,05737 : 0,04918 = 7 : 6 (наименьшие целые числа). Теперь проверим не содержало ли вещество Е***, кроме углерода и водорода, еще и кислород (других элементов Е***не содержит, поскольку продуктами сгорания являются только CO2 и H2O). Для этого вычислим суммарную массу углерода и водорода, входящих в Е***: (1,285л/22,4л/моль)×12г/моль + 2×(0,4426г/18г/моль) ×1г/моль = 0,7376 г. Значит, Е***содержит: 1,000г - 0,7376г = 0,2624г кислорода. Определим соотношение количества атомов углерода и кислорода в: (1,285л/22,4л/моль) : (0,2624г/16г/моль) = 0,05737 : 0,01640 = 7 : 2. Таким образом, состав вещества Е***– C7H6O2. Обратим внимание, что это вещество содержит очень мало атомов водорода на 7 атомов углерода, т.е. является производным ненасыщенного углеводорода – алкена, алкина или ароматического соединения. Однако, бромную воду Е***не обесцвечивает, и следовательно является производным бензола. Вычитая из состава C7H6O2 формулу фенильного фрагмента C6H5, получаем CHO2, т.е. карбоксильную группу. Таким образом, Е***- бензойная кислота при нагревании которой происходит декарбоксилирование и образуется токсичный бензол C6H6. Другие варианты строения Е***(например, гидрокси-бензальдегид) не соответствуют условиям задачи, поскольку дают реакции с бромной водой и аммиачным раствором оксида серебра.
За расчет состава Е***C7H6O2 – 10 баллов. За определение строения Е***C6H5COOH – 2 балла. За образование токсичного бензола из C6H5COOH − 2 балла.
Итого 14 баллов
Задача 11-6 (экспериментальная).
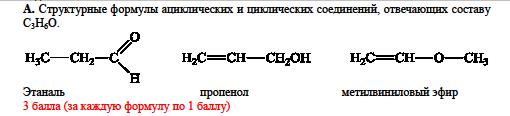
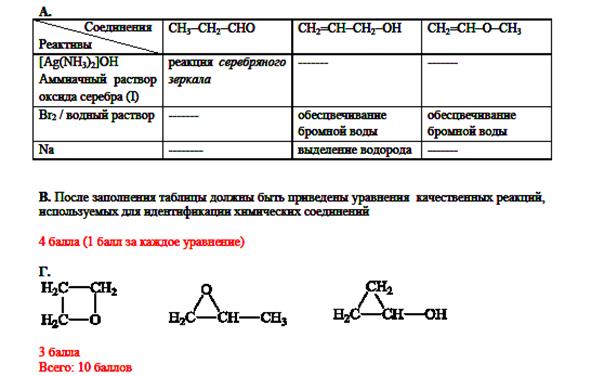
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|