
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решения заданий. Десятый класс
Решения заданий
Десятый класс
Задача 10-1.
1.Это был красный фосфор. 15Р – фосфор, p-элемент. (1 балла).
2. Элемент фосфор находится в третьем периоде. Он образует летучее водородное соединение с формулой РН3 и высший оксид Р2О5. При гидратации данного оксида образуется ортофосфорная кислота, кислотные свойства которой выражены слабее, чем у азотной. Неметаллические свойства фосфора более выражены, чем у кремния.
15Р 1s22s22p63s23p33d0
3s23p3 – 5 валентных электронов, 3 неспаренных электрона.
3s13p33d1– 5 валентных электронов, 5 неспаренных электронов.
4 полностью заполненных энергетических подуровня.
Наиболее характерные степени окисления: +5, +3, -3.
(5 баллов)
3. а) 4Р + 5О2 = Р4О10; (0,5 балл)
б) Р4О10 + 6Н2О = 4Н3РО4; (0,5 балл)
в) Р2О5 + 6NaОН = 2Na3РО4 + 3Н2О; (0,5 балл)
г) Р2О5 + 6 NaHCO3 = 2Na3РО4 + 6 СО2↑ + 3Н2О (1,5 балл)
4. Красный фосфор при контакте с хлоратом калия и механическом воздействии (растирании!) реагирует со взрывом:
12 Р + 10КСlО3 = 3 Р4О10 + 10 КСl
Азотная кислота превращает красный фосфор в фосфорную кислоту, а на воздухе он горит, превращаясь в белый «дым» – частички оксида фосфора (V), который гигроскопичен и мгновенно реагирует с влагой воздуха с образованием мельчайших капелек ортофосфорной кислоты:
Р + 5НNО3 = Н3РО4 + 5NО2 + Н2О
(4 балла)
Итого 12 баллов
Задача 10-2.
1) NaOH + CO2 = NaHCO3 при избытке углекислого газа
2 NaOH + CO2 = Na2CO3 + H2O при избытке щелочи
2) нет реакции
3) 2 NaOH + SiO2 = Na2SiO3 + H2O при сплавлении твердых веществ
4) 2 NaOH + Br2 = NaBr + NaBrO + H2O преобладает при охлаждении раствора
6 NaOH + 3 Br2 = 5 NaBr + NaBrO3 + 3 H2O преобладает при нагревании раствора
5) 2 NaOH + 2 Al + 6 H2O = 2 Na[Al(OH)4] + 3 H2
6) 2 NaOH + 2 NO2 = NaNO3 + NaNO2 + H2O
7) нет реакции
8) NaOH + НСl = NaCl + H2O
Итого 14 баллов
Задача 10-3.
Составлены уравнения реакций:
FeS + 2HCl → FeCl2 + H2S↑
Fe + 2HCl → FeCl2 + H2↑
n(HCl)=0,151 моль, n(FeS)=0,0455 моль, n(Fe)=0,03моль Определено вещество в избытке: HCl – 0,06 моль – в первой реакции, во второй реакции вещества прореагировали полностью
Вычислены количества образующихся веществ: n(FeCl2)=0,0455 моль, n(H2S)=0,0455 моль, n(H2)=0,03моль
Определена масса образовавшегося раствора: m(р-ра)= m(р-ра HCl) + m(FeS) + m(Fe) –m(H2S) – m(H2) = 27,5 + 4,0 + 1,68 – 1,55 – 0,06 = 31,57 г Определены массовые доли веществ в растворе: w(FeCl2) = 17,85%.
Итого 8 баллов
Задача 10-5.
Согласно закону Гесса (или закону сохранения энергии) тепловой эффект реакции равен разнице теплот образования продуктов и исходных веществ (с учетом стехиометрических коэффициентов). При этом теплота образования N2 и O2 из простых веществ, разумеется, равна нулю. Таким образом, для первой реакции можно записать: 6×394 кДж + 6×572 кДж = 1271 кДж + тепловой эффект реакции или 6CO2 + 6H2O = C6H12O6(р-р) + 6O2 – 4525 кДж. Знак минус у теплового эффекта указывает, что процесс требует затрат внешней энергии. В случае фотосинтеза цианобактерий это энергия Солнца. Для второй реакции:
6×572 кДж = 324 кДж + тепловой эффект реакции
или 2N2 + 6H2O = 4NH3(р-р) + 3O2 – 3108 кДж
Задача 10-6 (экспериментальная).
Данным реактивом является соляная кислота.
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O выделяется бесцветный газ
Na3PO4 + HCl → ничего не наблюдаем
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl наблюдаем выпадение бесцветного желеобразного осадка
AgNO3 + HCl → AgCl↓ + HNO3 наблюдаем выпадение белого осадка
За описание последовательности действий 5балла.
За уравнения реакций – по 1 баллу за каждое
За составление уравнений реакций в ионном виде по 0,5 балла
Итого 11 баллов
Задача 10-4.
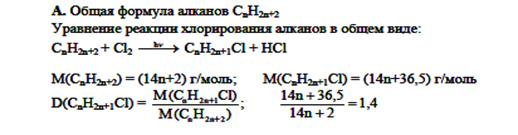
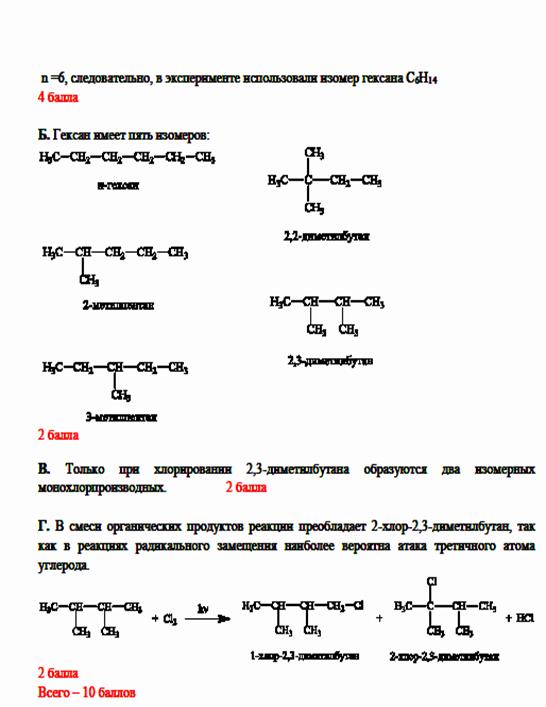
ВсОШ по химии, I школьный этап
2014-2015 учебный год
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|