- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
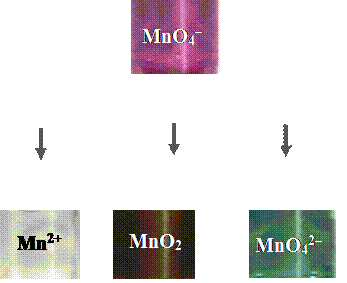
В кислых растворах образуется бесцветный катион Mn2+.
В кислых растворах образуется бесцветный катион Mn2+.
MnO4– + 8H+ +5e– " Mn2++ 4H2O; (E0= +1,53 В).
Из нейтральных растворов выпадает бурый осадок MnO2.
MnO4– +2H2O +3e– " MnO2 + 4OH–.
В щелочных растворах образуется зеленый анион MnO42–.
MnO4– + e– " MnO42– ; (E0 = +0,56В).
|
|
| |||
|
MnO4– + восстановитель | ||||
|
| ||||
| Кислая среда |
Нейтральная |
Щелочная среда | ||
|
|
| |||

Соединения марганца (+6)
Манганаты – соли с анионом MnO42– , имеют яркий зеленый цвет. Анион MnO42─ устойчив только в сильнощелочной среде. Под действием воды и, особенно, кислоты манганаты диспропорционируют с образованием соединений Mn в степени окисления 4 и 7.
3MnO42– + 2H2O = MnO2 + 2MnO4– + 4OH–
По этой причине кислота Н2MnO4 не существует.
Манганаты можно получить, сплавляя MnO2 с щелочами или карбонатами в присутствии окислителя.
2MnO2(к) + 4KOH (ж) + О2 = 2K2MnO4 + 2H2O
Манганаты являются сильными окислителями, но если на них подействовать еще более сильным окислителем, то они переходят в перманганаты.
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
 Окислительно–восстановительные свойства аниона MnO42– можно передать схемой:
Окислительно–восстановительные свойства аниона MnO42– можно передать схемой:

 MnO2 MnO2
| восстановитель + | MnO42– | + окислитель | MnO4– |
| Диспропорционирование | ||||
Соединения марганца (+4)
Оксид MnO2 – наиболее устойчивое соединение Mn. Этот оксид встречается в природе (минерал пиролюзит). Оксид MnO2 – черно-коричневое вещество с очень прочной кристаллической решеткой. По этой причине, несмотря на то, что оксид MnO2 является амфотерным, он не реагирует с растворами щелочей и с разбавленными. Он растворяется в концентрированных кислотах.
MnO2 + 4HCl (конц) = MnCl2 +Cl2 + 2H2O
Реакцию используют в лаборатории для получения Cl2.
При растворении MnO2 в концентрированной серной и азотной кислоте образуются Mn2+ и О2.
Таким образом, в очень кислой среде MnO2 стремится перейти в катион Mn2+.
С щелочами MnO2 реагирует только в расплавах с образованием смешанных оксидов. В присутствии окислителя в щелочных расплавах образуются манганаты.
Окислительные свойства диоксида лучше проявляются в кислой среде, в этом случае MnO2 восстанавливается до Mn2+.
E0 (Mn2+/MnO2) = +1,23 В.
Гидроксид Mn(+4) не выделен, при восстановлении перманганата и манганата в нейтральных или слабощелочных средах, а также при окислении Mn(OH)2 и MnOOH из растворов выпадает темно-бурый осадок гидратированного MnO2.
Оксид и гидроксид Mn(+3) имеют основной характер. Это твердые, бурого цвета, нерастворимые в воде и неустойчивые вещества.
При взаимодействии с разбавленными кислотами они диспропорционируют, образуя соединения Mn в степенях окисления 4 и 2.
2MnOOH + H2SO4 = MnSO4 + MnO2 + 2H2O
С концентрированными кислотами они взаимодействуют также как и MnO2, т.е. в кислой среде переходят в катион Mn2+. В щелочной среде легко окисляются на воздухе до MnO2.
Соединения марганца (+2)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|