
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Методы гистохимического анализа
1. Методы гистохимического анализа
Привлечение гистохимических исследований как методов выявления разнокачественности растений принято достаточно широко (Сабинин, 1963; Генкель, 1964; Гродзинский, 1964; Барская, 1967; Ахматов, 1968). Признаки физиологического состояния растений (морозостойкость, сроки выхода из состояния покоя, скорость роста, сроки макро- и микроспорогенеза и др.), обусловливают приспособленность организма к среде и его выживаемость (Сергеев, 1953; Уильямс, 1968; Холоденко, 1970; Лир, 1974; Либберт, 1976; Крамер, 1983; Карасев, 1997, 1998 а, б, в; 2000; 2001; Демаков, 2000; 2002 а, б; Карасева, 2003; Mencuccini, 2010; 2013).
Камеральный этап работы выполняется в лаборатории лесной селекции и генетики кафедры лесных культур НГСХА. Первичная единица выборки в гистохимическом опыте представлена временными препаратами поперечных срезов из средней части годичного прироста, которые после окрашивания и фиксации анализировались с помощью микроскопа Микмед-2. Кроме того они фотографировались с помощью микрофотонасадки, адаптированной к цифровой фотокамере «OLIMPUS», соединенной с телеэкраном. Наличие в клетках сахаров, крахмала и жиров оценивалось дифференцировано по учетным зонам каждой из тканей, привлеченных для анализа содержания этих веществ в соответствии с существующими разработками (Бессчетнова, 1975; Бессчетнов, 1994). Нами выделены следующие учетные зоны (рис. 3.1):
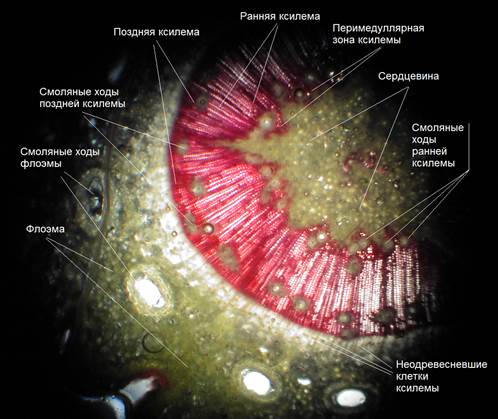
Рисунок 3.1 – Учетные зоны на поперечном срезе годичного побега
сосны обыкновенной (фото Н.Н. Бесчетновой)
- сердцевина;
- перимедуллярная зона ксилемы;
- сердцевинные лучи;
- ранняя ксилема;
- поздняя ксилема;
- смоляные ходы ранней ксилемы;
- смоляные ходы поздней ксилемы;
- смоляные ходы флоэмы;
- прикамбиальная зона флоэмы;
- прифеллогенная зона флоэмы;
- средняя зона флоэмы;
- корковая зона (зона паренхимных клеток, лежащая на периферии побега между феллогеном и внешней границей побега).
Оценка дается по следующим категориям учетов:
- по каждой учетной зоне тканей отдельно;
- в сумме баллов по всем учетным зонам;
- в средних значениях бальных оценок для учетной зоны.
По каждому плюсовому дереву (ортету) и его клонам (раметам) вычисляют средние значения. В качестве контроля визирования мы рекомендуем использовать неокрашенные срезы, не подвергавшиеся воздействию тестирующих реагентов (Бессчетнова, 2010 а; 2011 а). С ними сравнивают срезы, обработанные соответствующими реактивами. Окраска их клеток в ксилеме соответствует отсутствию лигнификации и запасных веществ. При проведении гистохимического анализа нами использовался собственный опыт выполнения таких работ (Бессчетнов, 2013 а; 2014 а; Бессченова, 2003 г; 2003 з; 2004 з; 2005 б, в; 2008 в; 2010 а; 2011 з; 2012 в, г;2013 а; 2014 д).
Наличие крахмала в тканях побегов связывают с устойчивостью растений к неблагоприятным зимним условиям. Исследования в данном направлении проводятся достаточно активно (Ericsson, 1983; Brahim, 1996; Ludlow, 1997; Kakei, 1999; Schaberg, 2000; Andersone, 2002; Bergström, 2003; Pardos, 2003; Jiménez, 2009; Mencuccini, 2010; Rodríguez-Calcerrada, 2010; Woodruff, 2011). Крахмал выявляли цветной реакцией на раствор Люголя (Прозина 1960; Гродзинский, 1964). Оценка его содержания давалась в условных балах по предложенной нами (Бессчетнова, 2006 а) с учетом существующих разработок (Бессчетнова, 1975; Бессчетнов, 1994) шкале. Мы с вами ранее рассматривали эту шкалу в качестве одного из примеров:
0 – крахмал отсутствует полностью: не удается обнаружить ни оного крахмального зерна ни в одной клетке учетной зоны ткани;
1 – крахмал в ограниченном количестве присутствует в единичных (до 10 %) клетках учитываемой ткани;
2 – крахмал присутствует в меньшем числе клеток: окрашенные крахмальные зерна удается зафиксировать примерно в 20 – 30 % клеток;
3 – крахмал фиксируется примерно в половине всех учитываемых клеток ткани (40 – 60 %);
4 – крахмал отмечается в большей части клеток (70 – 90 %);
5 – крахмал в большом количестве присутствует во всех клетках (100 %) учитываемой ткани.
Присутствие жиров и жироподобных веществ в тканях растений во многом предопределяет их резистентность к воздействию низких температур, обеспечивает сбалансированность многих процессов жизнедеятельности растительных организмов. Жиры фиксировались реакцией на Судан-III (Прозина, 1960); их содержание также учитывалось в условных балах по предложенной нами (Бессчетнова, 2006 а) шкале, пример которой нами уже рассмотрен в одной из ранее прочитанных лекций:
0 – окрашивание отсутствует на всей площади поперечного среза, различий в состоянии окрашенного среза и контрольного среза не обнаруживается;
1 – бледно-розовое окрашивание незначительной части учетной ткани или учетной зоны на поперечном срезе – наблюдается фрагментарное окрашивание поперечного среза (реакция на Судан-III у отдельных тканей или у некоторой их части);
2 – бледно-розовое окрашивание учетной ткани или учетной зоны полностью (вся визируемая поверхность среза приобретает слабо выраженные признаки реакции на Судан-III);
3 – интенсивное красно-оранжевое окрашивание части учетной зоны или учетной ткани (часть учетной зоны имеет интенсивное окрашивание);
4 – полное интенсивное окрашивание учетной зоны или учетной ткани (вся учетная зона имеет полное интенсивное окрашивание);
5 – на фоне интенсивного окрашивания учетной зоны наблюдается присутствие жира в капельножидком состоянии (ярко окрашенные капли жира отчетливо заметны в части или во всех учетных зонах).
Параллельно на каждом срезе учитывалось наличие суберина в корковой зоне: Судан-III дает окрашивание в оранжево-красный цвет.
Водорастворимые сахара, выступая основным продуктом фотосинтеза, активно участвуют в метаболизме и процессах регенерации древесных растений (Brahim, 1996; Ögren, 1997; Schaberg, 2000; Sevanto, 2003; Mencuccini, 2010; Woodruff, 2011; Husen, 2012). Растворимые сахара (моно - и дисахариды) обнаруживали реакцией Молиша с α-нафтолом (Прозина, 1960; Гродзинский, 1964). Их содержание также оценивалось в условных баллах по шкале, которая также вам уже знакома:
0 – окрашивание отсутствует на всей площади поперечного среза, различий в состоянии окрашенного среза и контрольного среза не обнаруживается;
1 – бледно-фиолетовое окрашивание незначительной части учетной ткани или учетной зоны на поперечном срезе – наблюдается фрагментарное окрашивание поперечного среза (реакция на α-нафтол у отдельных тканей или у некоторой их части);
2 – бледно-фиолетовое окрашивание учетной ткани или учетной зоны полностью (вся визируемая поверхность среза приобретает слабо выраженные признаки реакции на α-нафтол);
3 – хорошо выраженное фиолетовое окрашивание части учетной зоны или учетной ткани (часть учетной зоны имеет интенсивное окрашивание);
4 – полное хорошо выраженное фиолетовое окрашивание учетной зоны или учетной ткани (вся учетная зона имеет полное хорошо выраженное окрашивание);
5 –интенсивное темно-фиолетовое окрашивание учетной зоны (ярко окрашенные клетки отчетливо заметны во всех учетных зонах).
Состояние и темпы развития ксилемы древесных растений, процессы образования и лигнификации её клеток, соотношение между формируемыми при этом ранней и поздней древесиной, а также их наследственная обусловленность выступают предметом разносторонних исследований, проводимых у нас в стране (Ваганов, 1985; 2000; Бессчетнов, 2014 а; Бабушкина, 2015; Силкин, 2015) и за рубежом(Sundberg, 1994 a,b; Allona, 1998; Plomion, 2001; Uggla, 2001; Cochard, 2004; Hellgren, 2004; Perks, 2005; Gaspar, 2008; Lukjanova, 2008; Mantero, 2008; Fries, 2009; Gapare, 2009; Mast, 2009; Martínez-Vilalta, 2009; Ananías, 2010; Li, 2010; Kılıç, 2010; Gryc, 2011; Begum, 2012; Lloyd, 2012; Mencuccini, 2013; Dubouzet, 2014; Jyske, 2015; Scoffoni, 2015).
Одревеснение клетчатки в стенках клеток ксилемы оценивали с помощью качественной реакции лигнина на флороглюцин (Наумов, 1954; Прозина, 1960; Гродзинский, 1964; Барская, 1967). Степень лигинфикации ксилемы устанавливалась по соотношению зон с различной степенью лигнификации клеток. По каждой зоне отдельно велся учет количества рядов клеток в радиальном направлении, начиная от первого ряда в ранней ксилеме и заканчивая последним видимым рядом поздней ксилемы перед камбием, что позволяло выявить долю клеток с полным одревеснением, долю клеток с частичной лигнификацией (полуодревесневших) и долю клеток без лигнификации. Параллельно измерение каждой зоны проводилось окуляр-микрометром. Для формирования количественной оценки степени лигнификации клеток ксилемы в процентах все количество рядов клеток ксилемы (ранней и поздней) принималось за 100%. Количество рядов полуодревесневших клеток распределялось между двумя крайними их категориями (полностью одревесневших и не одревесневших) в равной пропорции. Кроме того, по каждому состоянию лигнификации составлялись структурные уравнения в долях участия каждой категории и в количественном (по количеству клеток в каждом ряду). При этом каждый установленный уровень лигнификации клеток ксилемы мы рекомендуем обозначать буквенным индексом (символом):
- «Л» – полностью одревесневшие (лигнифицированные) клетки;
- «ПЛ» – полуодревесневшие клетки;
- «НЛ» – не одревесневшие (не лигнифицированные)клетки.
Перед каждым буквенным индексом (символом) ставился числовой коэффициент, обозначающий долю каждой из категорий клеток в их общем количестве или количество рядов каждой категории, с указанием итогового равенства или суммарного количества рядов в итоге. Соотношение зон ранней и поздней ксилемы оценивали количественно по соотношению числа рядов клеток в каждой из них на окончание вегетационного периода, когда все клетки поздней ксилемы претерпели лигнификацию. Оценку следует давать в десятичных дробных числах.
В соответствие с вышеизложенным, для построения интегральной оценки текущего состояния ксилемы учитывали следующие показатели, определяющие степень её развитости и уровень лигнификации в наблюдаемом секторе визирования, охватывающем все учетные зоны от сердцевины до камбия:
- общее количество рядов клеток ксилемы, сформировавшейся на текущий момент, которое определялось подсчетом всех клеток ксилемы в независимости от факта и степени их лигнификации;
- количество рядов полностью одревесневших клеток ранней ксилемы, которое определялось учетом тех рядов клеток, в стенках которых полностью завершен процесс лигнификации, что подтверждалось их равномерной интенсивной розовой окраской, соответствующей оценке 5 баллов;
- количество рядов абсолютно не одревесневших клеток ксилемы, которое определялось учетом только тех клеток, в стенках которых не фиксируются признаки лигнификации, то есть отсутствует какое-либо окрашивание или оценка 0 баллов;
- количество рядов частично одревесневших клеток ксилемы, которое определялось учетом только тех клеток, процесс лигнификации стенок которых фиксируется, но незавершен полностью, что подтверждалось их равномерной бледно-розовой окраской – окраской разной интенсивности: от 1 до 4 баллов;
- общая глубина одревеснения клеток ксилемы с учетом коэффициента бальной оценки уровня её лигнификации, которая определялась как сумма произведений числа рядов клеток отдельной учетной зоны ксилемы на балл её лигнификации (от 0 до 5 баллов), отнесенных к максимальной балльной оценке (5 баллов), и выражалась в скорректированном на степень лигнификации числе рядов клеток ксилемы;
- абсолютный процент одревеснения клеток ксилемы, который определялся как процентная доля одревесневших в той или иной степени клеток относительно общего числа клеток ксилемы;
- относительный процент одревеснения клеток ксилемы, который определялся как процентная доля полностью одревесневших и скорректированного на степень лигнификации числа рядов клеток ксилемы относительно общего числа клеток ксилемы;
- общая сумма рядов полностью одревесневших клеток ранней и поздней ксилемы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|