
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Содержание работы. Таблица №1
2. Содержание работы
2.1 Методика эксперимента:
Для исследования зависимости скорости реакции от концентрации и температуры используется реакция взаимодействия серной кислоты H2SO4 и тиосульфата натрия Na2S2O3. Эта реакция протекает в две стадии:
1) Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4,
2) H2S2O3 = H2O + SO2 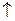 + S
+ S 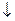 .
.
Экспериментально доказано, что первая стадия протекает с большей скоростью. Скорость всей реакции в целом определяется скоростью второй (медленной) стадии:
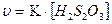 .
.
Поскольку концентрация H2S2O3 в растворе прямо пропорциональна концентрации Na2S2O3, скорость реакции можно рассматривать как:
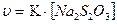 .
.
Опыт №1
Зависимость скорости реакции от концентрации Na2S2O3:
В три большие пробирки налить 2%-ный раствор Na2S2O3 и воду. Затем в три маленькие пробирки налить по 5 мл 2%-ного раствора H2SO4.
В первую большую пробирку с раствором Na2S2O3 прилить 5мл раствора H2SO4 (из маленькой пробирки) и замерить секундомером, через сколько секунд 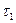 после слияния растворов наблюдается появление серы (помутнение раствора). С последующими пробирками проделываем аналогичные опыты, замеряем время
после слияния растворов наблюдается появление серы (помутнение раствора). С последующими пробирками проделываем аналогичные опыты, замеряем время 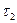 и
и 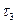 .
.
Результат трех измерений ( 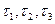 ) записываем в таблицу №1.
) записываем в таблицу №1.
Опыт №2
Зависимость скорости реакции от температуры:
Налить в одну пробирку 10мл раствора Na2S2O3, в другую 10 мл раствора H2SO4. Обе пробирки закрепить зажимами с деревянными рукоятками и опустить в водяной термостат ТС-24А. После выдержки пробирок в термостате при температуре t1 в течение 5-7 мин слить вместе содержимое обеих пробирок, отметив время 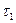 от момента сливания до помутнения раствора.
от момента сливания до помутнения раствора.
Проделать аналогичные опыты при температурах t2=t1+100 и t3=t2+100. Температура t1 задается преподавателем.
Результаты наблюдений ( 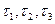 ) при температурах t1,t2,t3 записываем в таблицу №2.
) при температурах t1,t2,t3 записываем в таблицу №2.
Во время работы с термостатом запрещается:
1) работать без заземления термостата;
2) вскрывать коробку с электрическими переключателями;
3) опускать руки в термостат при включенной мешалке.
2.2 Экспериментальные результаты работы:
Таблица №1
| Номер задания | Номер опыта | Объем, мл | Концентрация
| Время
| Относительная скорость реакции | |
| Na2S2O3 + H2O (a) (b) | H2SO4 (c) | |||||
| 5 + 5 10 + 10 15 + 15 | 0,33 0,4 0,43 | t1=79 t2=64 t3=60 | t1/t2=1,24 t1/t3=1,31 | |||
| 5 + 10 10 + 5 15 + 0 | 0,25 0,5 0,75 | t1=109 t2=61 t3=39 | t1/t2=1,79 t1/t3=2,79 | |||
| 10 + 10 15 + 5 20 + 0 | 0,4 0,6 0,8 | t1=68 t2=57 t3=37 | t1/t2=1,19 t1/t3=1,84 | |||
Скорость реакции считаем в относительных единицах, при этом за единицу принимается скорость для наименьшей концентрации Na2S2O3.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
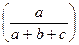
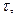 c
c