
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Скорость химических реакций.
Скорость химических реакций.
- Введение
1.1 Цель работы:
Изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
1.2 Основные теоретические положения, лежащие в основе работы:
Согласно закону действующих масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, равной стехиометрическому коэффициенту перед формулой данного вещества в уравнении реакции.
Условием протекания реакции является столкновение молекул, однако результативными оказываются те столкновения, в которых принимают участие так называемые «активные» молекулы. При повышении температуры энергия вещества и перераспределяется между молекулами таким образом, что значительно увеличивается число активных молекул, т.е. таких молекул, которые в момент столкновения обладают некоторым избытком энергии над средней энергией частиц. Избыточная энергия носит название энергии активации. Энергией активации реакции называется минимальная энергия (в расчете на 1моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции.
1.3 Формулы для вычислений, перечень символов:
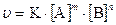 ,
,
где K – константа скорости реакции, зависящая от природы реагирующих веществ; 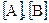 - концентрации реагирующих веществ,
- концентрации реагирующих веществ, 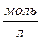 ; m, n – стехиометрические коэффициенты.
; m, n – стехиометрические коэффициенты.
Скорость большинства гомогенных реакций согласно эмпирическому правилу Вант-Гоффа при повышении температуры на100 увеличивается в 2-4 раза.
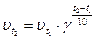 ,
,
где 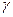 - температурный коэффициент реакции, принимающий значения 2-4 для большинства реакций;
- температурный коэффициент реакции, принимающий значения 2-4 для большинства реакций;  и
и 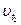 - скорости реакции при температурах t1 и t2.
- скорости реакции при температурах t1 и t2.
Интегрирование в интервале T1 –T2 уравнения Аррениуса
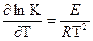
при допущении, что в малом температурном интервале E не зависит от температуры, позволяет вычислить энергию активации:
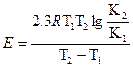 ,
,
где Е – энергия активации, кДж; R – универсальная газовая постоянная (8,314  ); T1 и T2 – абсолютная температура, К.
); T1 и T2 – абсолютная температура, К.
Для приближенных расчетов отношение К2/К1 может быть заменено отношением
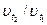
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|