
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Сн = n экв.a : V р-ра
Сн = n экв.a : V р-ра
Сн -нормальная концентрация [моль/л]
1Н - однонормальный раствор Сн =1 моль/л
0,1Н - децинормальный раствор Сн=0,1 моль/л
0,01Н - сантинормальный раствор Сн=0,01 моль/л
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов H водорода или замещает то же его количество в химических реакциях.
Например, в соединениях HCl, H2S, NH3, CH4 эквивалент хлора, серы, азота, углерода равен соответственно 1 моль, ½ моль, 1/3 моль, ¼ моль
Значит эквивалентные массы перечисленных выше веществ равны:
34,45 г/моль, 32/2 = 16 г/моль, 14/3 = 4,67 г/моль, 12/4 = 3 г/моль
Значение 1 моля соединения – величина постоянная, а грамм-эквивалент одного и того же вещества не является величиной постоянной, так как определяется той реакцией, в которой участвует это вещество. Например, взаимодействие серной кислоты со щелочью может идти так:
H2SO4+KOH=KHSO4+H2O
или
H2SO4+2KOH=K2SO4+2H2O
В первой реакции 1 молекула кислоты реагирует с 1 молекулой NaOH, т.е. 1 молекула кислоты эквивалента 1 эквиваленту водорода или 1 эквиваленту щелочи. Поэтому эквивалент H2SO4 равен ее молекулярной массе:
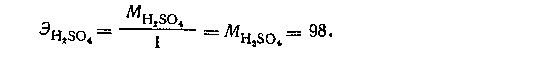
Грамм-эквивалент H2SO4 в этой реакции равен 98г.
Во второй реакции 1 молекула кислоты соответствует 2 эквивалентам водорода (или 2 эквивалентам щелочи). Поэтому,
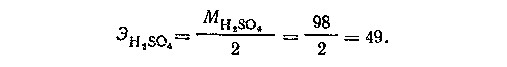
Грамм-эквивалент H2SO4 в этой реакции равен 49г.
Очевидно, для нахождения грамм-эквивалента того или иного вещества в данной реакции нужно составить уравнение реакции и затем рассчитать значение грамм-эквивалента.
6. Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльная концентрация (моляльность,[5] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
mB= nB/mA,
где:
· nB— количество растворённого вещества, моль;
· mA — масса растворителя, кг.
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|