
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
1. Реакции замещения. 2. Реакции присоединения. 1.Реакции замещения
1. Реакции замещения
- Замещение атомом галогена атома водорода при действии света по радикальному механизму:
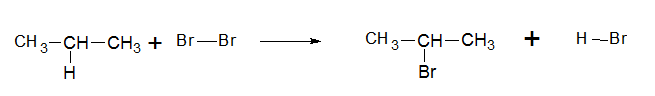
- Замещение атомом галогена функциональной группы по ионному механизму (в присутствии концентрированной серной кислоты):
C3H7− OH + HCl → C3H7− Cl + HOH
C3H7OH+SOCl2 ⟶ C3H7OSOCl + HCl ⟶ C2H5Cl + SO2 + HCl
2. Реакции присоединения
Присоединение галогенов к алкенам происходит в присутствии четыреххлористого углерода при 0°С:
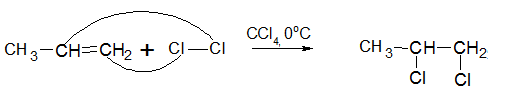
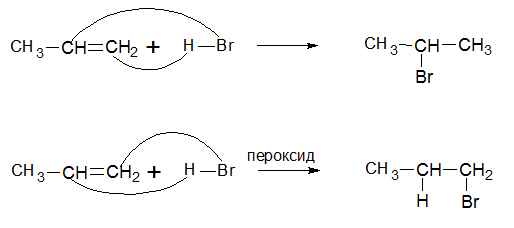
Присоединение галогенводородов к алкенамс происходит согласно правилу Марковникова — присоединение атома водорода происходит к наиболее гидрогенизированному атому углерода, атома галогена – к наименее гидрогенизированному атому углерода.
Однако, в определенных условиях один из галогенводородов, а именно бромоводород способен присоединяться к алкенам и против правила Марковникова.
 3. Реакция обмена
3. Реакция обмена
Обмен галогенами галогеналкана и йодида натрия используется для получения иодопроизводных:
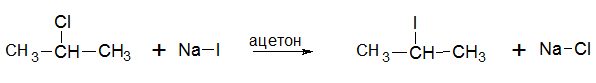
Химические свойства галогеналканов
1. Реакции замещения
Атом углерода в молекуле галогеналканов имеет частичный положительный заряд (δ +), в связи с чем он легко вступает в реакции с нуклеофилами (ОН—, CN—, NH3, Н2О) и реакции замещения протекают достаточно легко. Ниже представлена схема и примеры реакций замещения галогеналканов:
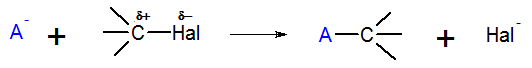
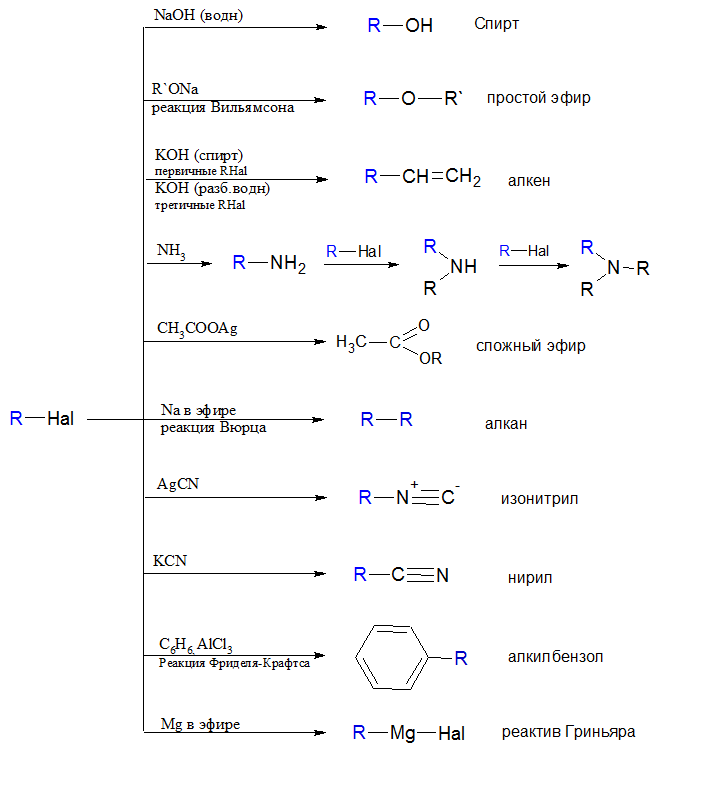
Легкость протекания таких реакции, зависят как от строения галогеналкана и природы входившего в его состав галогена, так и от природы нуклеофила. Реакционная способность галогеналканов уменьшается в ряду С-I < С-Br< С-Сl< С-F. Таким образом, самыми прочными в данном ряду являются связи С-F, поэтому фторалканы не охотно вступают в реакции нуклеофильного замещения.
2. Реакции отщепления.
Реакция протекает с отщеплением галогенводорода от молекулы галогеналкана при действии на них сильных оснований:
R-CH2-CH2Cl + KOH → R-CH=CH2 + KCl + H2O
Применение галогеналканов

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|