
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
2- Бензонафтол
Ацилирование
Ацилирование - это введение в органическое соединение остатка карбоновой кислоты R-СО __ , называемого ацилом. В зависимости от R ацил имеет более конкретное название (Н-СО – формил, СН3-СО – ацетил, С6Н5-СО – бензоил, СН3-СН2-СО – пропионил, и т. д. ), в связи с этим и реакции ацилирования носят соответствующие названия: реакция формилирования (R=H), ацетилирования (R=СH3), бензоилирования (R=С6H5) и т. п.
Ацилирующими агентами могут быть не только кислоты, но и их производные R-CО-Х: галогенангидриды (Х=Cl, Br), ангидриды (Х= ОСОR¢ ), эфиры (Х= OR¢ ), амиды. (Х= NH2).
Ацилируемые вещества могут быть:
аминами (первичными или вторичными), аммиаком, гидразинами ( N -нуклеофилы);
спиртами, фенолами, водой ( О -нуклеофилы);
тиолами ( S -нуклеофилы);
аренами, метиленактивными соединениями ( С -нуклеофилы).
Почти всегда ацил замещает в ацилируемом соединении водород. Наиболее легко замещается водород, связанный с атомом азота (N-ацилирование) или кислорода (О-ацилирование), возможно также S- и С- ацилирование. Широко известная реакция этерификации (образование сложного эфира при взаимодействии спирта и кислоты) является разновидностью реакции ацилирования:

В этой реакции на ацил замещается водород, связанный в молекуле спирта с атомом кислорода, т. е. идет процесс О-ацилирования. Подобным образом ведут себя и фенолы.
Ацилирование представляет собой реакцию нуклеофильного замещения фрагмента Х в кислоте и ее производных на нуклеофил (Y). Механизм реакции ацилирования включает стадию присоединения нуклеофила по связи С=О с образованием тетраэдрического интермедиата с последующим элиминированием группы Х:
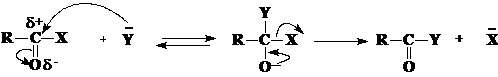
Из схемы следует, чем больше величина положительного заряда на атоме углерода карбонильной группы субстрата и чем выше нуклеофильность реагента, тем выше скорость реакции. По ацилирующей способности производные карбоновых кислот располагаются в следующий ряд:
галогенангидрид > ангидрид > кислота > сложный эфир > амид.
Реакция между соединениями, обладающими высокой ацилирующей способностью (например, галогенангидридом кислоты), и соединениями, являющимися хорошими нуклеофилами (например, аминами), может проходить без катализатора очень активно и даже требовать охлаждения. Так получают амиды и алкиламиды карбоновых кислот.
В других же случаях ацилирование проходит только в присутствии катализатора при повышенной температуре. Например, кетоны из аренов по реакции Фриделя-Крафтса получают в присутствии кислот Льюиса. Реакция этерификации в большинстве случаев требует добавки сильной кислоты (серной, фосфорной, сульфокислоты, пропускания хлороводорода и т. п. ). Почти всегда роль катализатора заключается в увеличении положительного заряда на атоме углерода карбонильной группы ацилирующего агента, что способствует более быстрому присоединению молекулы нуклеофила.
В случае реакции этерификации механизм реакции при кислотном катализе может быть представлен следующей схемой:
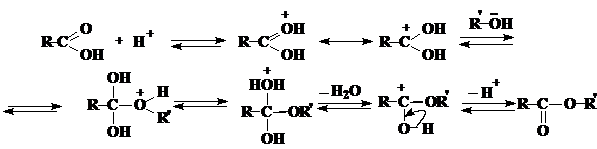
Реакция этерификации обратима. Чтобы сдвинуть равновесие в сторону образования сложного эфира, используют либо избыток одного из реагентов (обычно спирта), либо удаляют воду путем азеотропной отгонки с ловушкой Дина-Старка, либо отгоняют эфир, если он имеет более низкую температуру кипения, чем исходные вещества (например, при получении этилформиата).
Сильное влияние на процесс этерификации оказывают пространственные факторы. С увеличением объема радикала в спирте скорость этерификации понижается. При переходе от первичных спиртов к третичным резко падает выход эфиров.
Реакцию ацилирования можно вести и при основном катализе. Увеличение электронной плотности на атоме - нуклеофиле также облегчает образование промежуточного комплекса. Например, ацилирование фенолов галогенангидридами кислот ведут в присутствии раствора щелочи (реакция Шоттена-Баумана).
2- Бензонафтол
Цель работы: 1. Ознакомиться с условиями ацилирования фенолов.
2. Освоить технику полумикроперекристаллизации.
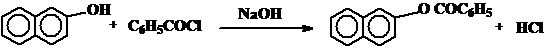
Реактивы: b-Нафтол................ …………….... 0, 36 г (0, 0025 моль)
Бензоил хлорид….......... ………….. 0, 45 г (0, 4 мл, 0, 003 моль)
Едкий натр, 10%-ый раствор …...... 5 мл
Этиловый спирт
Осторожно! Бензоил хлорид - лакриматор, работать в вытяжном шкафу!
В пробирку объемом 15-20 мл помещают 0, 36 г 2-нафтола, добавляют 5 мл 10%-ного раствора едкого натра и встряхивают до растворения нафтола. Затем постепенно, при энергичном встряхивании добавляют по каплям 0, 4 мл бензоилхлорида. Каждую последующую каплю бензоилхлорида добавляют после того, как прореагировала предыдущая порция (определяют по запаху). Затем реакционную смесь осторожно нагревают (избегать закипания! ) над электроплиткой 5-10 минут.
По охлаждении водой бензонафтол выпадает в осадок. Его отфильтровывают на фильтре Шотта, промывают сначала 5%-ным раствором едкого натра, а затем водой до нейтральных промывных вод и сушат на воздухе.
Выход около 0, 6 г
100-150 мг полученного препарата перекристаллизовывают из этанола (см. описание полумикроперекристаллизации с. 34, рис. 9), сушат, взвешивают и определяют температуру плавления.
Лит. данные: т. пл. бензонафтола 107º С.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|