
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
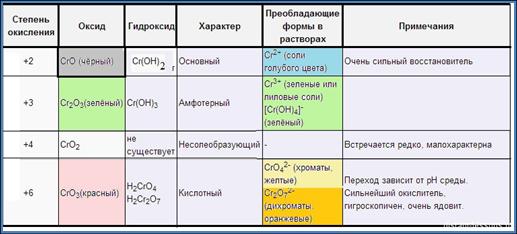
Оксид хрома CrO3(VI) (хромовый ангидрид)
Оксид хрома CrO3(VI) (хромовый ангидрид)
Физические свойства CrO3(VI):
· кристаллы красно-фиолетового цвета;
· разлагаются при комнатной температуре;
· расплывается на воздухе по причине высокой гигроскопичности;
· хорошо растворим в воде.
Химические свойства CrO3(VI):
· CrO3(VI) является кислотным оксидом;
· растворяясь в воде, образует хромовые кислоты:
o хромовая кислота: CrO3+H2O(изб) = H2CrO4
o дихромовая кислота: 2CrO3+H2O(нед) = H2Cr2O7
· реагирует с основаниями: CrO3+2KOH = K2CrO4+H2O
· CrO3 окисляет углерод, серу, фосфор, йод, образуя оксид хрома (III):
· 4CrO3+3S = 3SO2+2Cr2O3
· нагретый до температуры выше 250°C, триоксид хрома разлагается на молекулярный кислород и оксид хрома (III): 4CrO3 = 2Cr2O3+3O2
Триоксид хрома получают действием концентрированной серной кислоты на концентрированные растворы хроматов/дихроматов калия/натрия:
K2Cr2O7+H2SO4 = 2CrO3↓ +K2SO4+H2O
Гидроксидыхрома
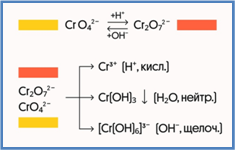
К гидроксидам хрома относятся две кислоты - хромовая и дихромовая, существующие только в водных растворах, но образующие очень устойчивые соли - хроматы и дихроматы соответственно. Хроматы окрашивают раствор в желтый цвет; дихроматы - в оранжевый.
Кислоты образуются в результате взаимодействия с водой триоксида хрома - если вода присутствует в избытке, образуется хромовая кислота, если в недостатке - дихромовая: CrO3+H2O(изб) = H2CrO4
2CrO3+H2O(нед) = H2Cr2O7
Примечательно, что хромат-ионы и дихромат-ионы при изменении среды растворов без проблем переходят друг в друга, меняя при этом окраску раствора:
· в кислой среде хроматы переходят в дихроматы, меняя желтый цвет раствора на оранжевый:
· 2CrO42-+2H+ ↔ Cr2O72-+H2O 2K2CrO4+H2SO4 ↔ K2Cr2O7+K2SO4+H2O
· в щелочной среде все происходит наоборот - дихроматы переходят в хроматы, а оранжевый цвет раствора меняется на желтый:
· Cr2O72-+2OH- ↔ 2CrO42-+H2O K2Cr2O7+2KOH = 2K2CrO4+H2O
Хроматы получают сплавлением хромистого железняка или оксида хрома (III) с карбонатами в присутствии кислорода (t=1000°C):
4Fe(CrO2)2+8Na2CO3+7O2 = 8Na2CrO4+2Fe2O3+8CO2
Дихроматы получают из растворов хроматов, подкисляя их.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|