
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
2. Ферменты і ферментатыўны каталіз.
Біяхімічныя рэакцыя абмену рэчываў не могуць у абсалютнай большасці ісці самаадвольна, яны ідуць дзякуючы ферментам.
Ферменты – гэта біялагічныя каталізатары біяхімічных рэакцый бялковай прыроды.
Функцыі ферментаў:
1. Ажыцяўляюць каталіз біяхімічных рэакцый.
2. Забяспечваюць узаемасувязь і ўпарадкаванасць рэакцый.
3. Праз ферменты ажыцяўляецца рэгуляцыя метабалізму.
Ферменты падзяляюцца на простыя (пратэіны) і складаныя (пратэіды), якія маюць бялковую частку (апафермент) і небялковую частку (кафактар).
Тыпы кафактараў:
1. Прастатычная група – гэта небялковая частка, якая не адзяляецца ад бялковай часткі фермента (ФАД, ФМН).
2. Кафермент – арганічная малекула, якая можа лёгка аддзяліцца ад бялковай часткі фермента (НАД, НАДФ).
3. Іёны металаў – могуць уваходзіць у склад малекул ферментаў ці могуць не ўваходзіць у іх склад, але выконваюць функцыі злучэння малекулы фермента з малекулай субстрата, г. з. бялковую частку з небялковай (Fe, Cu, Co, Mg, Ca, K, Mn, Zn і іншыя).
Асобыя часткі малекулы фермента ўтвараюць актыўны цэнтр. Ён забяспечвае сувязь малекулы фермента з малекулай субстрату.
Некаторыя кафактары уваходзяць у склад рэчываў, якія неабходны арганізму для жыццядзейнасці і называюцца вітамінамі. Вітаміны – физіялагічна актыўныя рэчывы, якія ўдзельнічаюць у метабалічных працэсах.
Ферменты забяспечваюць працяканне біяхімічнай рэакцыі шляхам зніжэння яе энергетычнага бар’еру да узроўню, які пераадольваецца пры звычайных умовах.
Ферментатыўная рэакцыя працякае ў тры этапы: утварэнне фермент-субстратнага комплексу, актыва-цыя ФСК, утварэнне прадуктаў рэакцыі і аддзяленне іх ад фермента.
Уласцівасці ферментаў:
1. Спецыфічнасць – абумоўлена тым, што на мале-кулярным узроўні канфармацыя фермента адпавядае канфармацыі малекулы субстрату. Гэта азначае, што малекула субстрату, па Э. Фішэру (ням. біяхімік) “падыходзіць да фермента як ключ да замка” і таму субстрат можа далучацца толькі да свайго фермента.
2. Высокая каталітычная актыўнасць. Ферменты каталізуюць рэакцыі значна хутчэй, чым неарганічныя каталізатары (плаціна, серная кісліна і інш. ).
Ферментатыўная актыўнасць расліннай тканкі, у якой утрымліваецца фермент, разлічваецца па формуле: Аф = Р/tM; дзе А – колькасць прадуктаў ферментатыўнай рэакцыі, ўтвораных за адзінку часу ў разліку на адзінку масы расліннай тканкі, ў якой знаходзіцца вывучаемы фермент; Р – колькасць прадуктаў ферментатыўнай рэакцыі; t – працяглась рэакцыі; М – маса расліннай тканкі.
Р/t=Vф – хуткасць ферментатыўнай рэакцыі.
3. Лабільнасць – зменлівасць актыўнасці. Работа ферментаў залежыць ад знешняга асяродзя – ад тэмпературы і ад рН. Пры 60 градусах Цэльсія бялкі-ферменты дэнатуруюць, а значыць гібнуць клеткі. Тэмпература жыццядзейнасці клеткі змяняецца ад 0 да 60 градуса па Цэльсію. Тэмпературны оптымум знаходзіцца ў межах 35-40 градусаў.
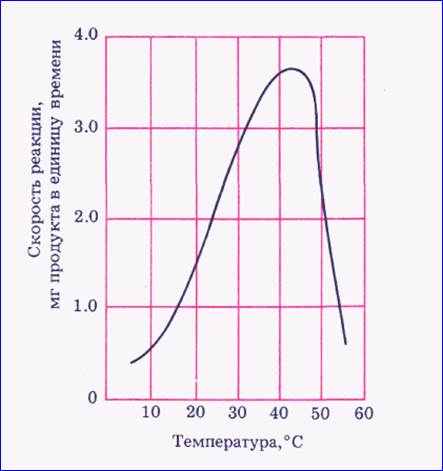
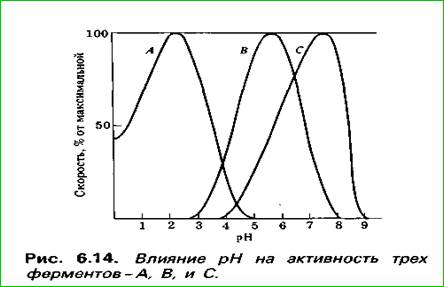
Для кожнага фермента ёсць свой аптымальны рН, пры якім актыўнасць найбольшая. Адхіленне рН ад оптымуму, вядзе да парушэння канфармацыі малекулы і фермент перастае каталізаваць.
Залежнасць хуткасці рэакцыі (і актыўнасці фермента) ад рН:
Класіфікацыя і наменклатура ферментаў. Ферменты дзеляцца на 6 класаў. Наменклатура – назвы ферментаў.
Першы клас ферментаў – аксідарэктуктазы. Яны ажыццяўляюць каталіз акісляльна-аднаўляльных рэакцый.
Віды рэакцый, якія катализуюць аксіда-рэдуктазы:
1. Рэакцыі пры якіх адбываецца перанос электронаў.
 AFe2+ AFe3+ + ē
AFe2+ AFe3+ + ē
2. Рэакцыі пры якіх адбываецца перанос вадароду:
 Аd- Н2б+ А0 + 2H+ + 2ē
Аd- Н2б+ А0 + 2H+ + 2ē
3. Калі пераносіцца кісларод:
 Аd+ О2d- А0 + O20
Аd+ О2d- А0 + O20
Кафактары аксідарэдуктаз, якія каталізуюць рэакцыі тыпу 2:
 НАД – нікацінаміддынукліятыд
НАД – нікацінаміддынукліятыд
Каферменты
НАДФ – нікацінаміддынукліятыдфасфат
 ФАД – флавінадэніндынукліятыд
ФАД – флавінадэніндынукліятыд
Прастатычныя групы
ФМН – флавінмонанукліятыд
Ферменты, якія каталізуюць рэакцыі 1 тыпу, маюць у якасці прастатычнай групы цытахромы. Асновай будовы малекулы з'яўляецца парфірынавая структура, як у хларафіла. Аднак замест магнію там – жалеза.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|