
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задание. Алкины. Способы получения
Задание
Конспект по теме «Алкины»
Алкины
Цель урока: изучить строение, номенклатуру, способы получения, физические и химические свойства, применение алкинов.
План лекции:
1. Строение алкинов
2. Способы получения
3. Физические свойства
4. Химические свойства
5. Применение алкинов
Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своем составе тройную С≡ С связь. Общая формула алкинов с одной тройной связью СnH2n-2.
Простейший представитель ряда алкинов СНº СН имеет тривиальное название ацетилен. По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путём замены суффикса –ан на –ин: этан (СН3-СН3) – этин (СНº СН); пропан (СН3-СН2-СН3) - пропин (НСº С-СН3); и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т. е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса – ин. Часто алкины называют по принципу замещения атомов водорода в ацетилене на углеводородные радикалы, например, метилацетилен НСº С-СН3.
В образовании тройной связи участвуют атомы углерода в sp-гибридизованном состоянии. Каждый из них имеет по две sp-гибридных орбитали, направленных друг к другу под углом 1800, и две негибридных р-орбитали, расположенных под углом 900 по отношению друг к другу и к sp-гибридным орбиталям.
Пространственное строение ацетилена:


Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами. Пространственная изомерия относительно тройной связи в алкинах не существует.
Способы получения
1. СаО + 3С 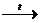 СаС2 + СО; СаС2 + 2H2O®Ca(OH)2 + СHº CH (получение ацетилена)
СаС2 + СО; СаС2 + 2H2O®Ca(OH)2 + СHº CH (получение ацетилена)
2. 2CH4 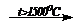 НCº СН + 3H2 (крекинг углеводородов)
НCº СН + 3H2 (крекинг углеводородов)
3. CH3-CHCl2 + 2KOH 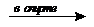 HCº СH + 2KCl + H2O (дегалогенирование)
HCº СH + 2KCl + H2O (дегалогенирование)
CH2Cl-CH2Cl + 2KOH 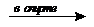 HCº СH + 2KCl + H2O
HCº СH + 2KCl + H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|