
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опыт 4. (под тягой).
Опыт 4. (под тягой).
В раствор соли висмута пропустили ток сероводорода (выпал осадок коричнево-чёрного цвета). Испытали растворимость полученного осадка в растворе сульфида аммония (осадок не растворился). Висмут - типичный металл, не склонный к образованию анионов, в то время как сурьма – амфотерный элемент (металлоид). Из вышесказанного следует, что сульфид висмута должен растворяться в концентрированных сильных кислотах.
2BiCl3 + 3H2S = Bi2S3 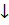 + 6HCl
+ 6HCl
2Bi3+ + 3S2- = Bi2S3 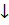
Bi2S3+ 6HCl(конц) = 2BiCl3 + 3H2S (обратный процесс)
Bi2S3 + 6H+ = 2Bi3+ + 3H2S
Опыт 5.
В азотнокислый раствор сульфата марганца добавили немного висмутата натрия, взболтали и дали отстояться. Появилось малиново-фиолетовое окрашивание, характерное для перманганат-ионов.
5NaBiO3 + 2MnSO4 + 16HNO3 = 5Bi(NO3)3 + 2HMnO4 + NaNO3 + 2Na2SO4 + 7H2O
5 BiO3- + 2Mn2+ + 14H+ = 5Bi3+ + 2MnO4- + 7H2O
Опыт 6.
Испытайте отношение висмутата натрия к раствору серной кислоты и концентрированной соляной кислоты. В обоих случаях наблюдалось выделение бесцветных газов и обесцвечивание растворов
2NaBiO3 + 4H2SO4 = Bi2(SO4)3 + Na2SO4 + O2 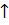
2BiO3- + 8H+ 2H2O = 2Bi3+ + 4H2O + O2
NaBiO3 + 6HCl = BiCl3 + NaCl + Cl2 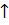 + 3H2O
+ 3H2O
BiO3- + 6H+ +2Cl- = 2Bi3+ + 3H2O + Cl2 
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|