
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа №5
Иониной Ирины501-2
Лабораторная работа №5
Сурьма, висмут
Опыт 1.
Из солянокислого раствора хлорида сурьмы (III) при помощи минимального количества раствора щелочи получили осадок и испытали его на растворимость в кислоте и щелочи. (Щелочь нужна в небольшом количестве, т. к. полученный гидроксид в избытке щёлочи будет растворяться). Проделали этот же опыт с хлоридом висмута (III). Получившийся осадок в щелочи не растворяется.
SbCl3 + 3NaOH = Sb(OH)3  + 3NaCl
+ 3NaCl
Sb3+ + 3OH- = Sb(OH)3 
Sb(OH)3 + 3NaOH = Na3[Sb(OH)6]
Sb(OH)3 + 3OH- =[Sb(OH)6]3-
Sb(OH)3 + 3HCl = SbCl3 + 3H2O
Sb(OH)3 + 3H+ = Sb3+ + 3H2O
BiCl3 + 3NaOH = Bi(OH)3  + 3NaCl
+ 3NaCl
Bi3+ + 3OH- = Bi(OH)3 
Bi(OH)3 + 3HCl = BiCl3 + 3H2O
Bi(OH)3 + 3H+ = Bi3+ + 3H2O
Bi(OH)3 + 3NaOH – реакция не идёт.
Опыт 2.
В концентрированный раствор хлорида сурьмы (III) добавляли по каплям дистиллированную воду до выпадения осадка (выпал белый осадок). Испытали осадок на растворимость в концентрированной соляной кислоте. Что вызвано обратным смещением равновесия избытком ионов водорода.
SbCl3 + H2O 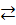 Sb(OH)Cl2 + HCl
Sb(OH)Cl2 + HCl
Sb(OH)Cl2 + H2O 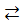 Sb(OH)2Cl + HCl
Sb(OH)2Cl + HCl
Sb(OH)2Cl 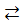 SbOCl
SbOCl 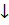 + H2O
+ H2O
Sb3+ + H2O 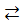 SbOCl
SbOCl 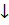 + 2H+
+ 2H+
SbOCl 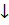 + 2HCl
+ 2HCl 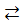 SbCl3 + H2O
SbCl3 + H2O
SbCl3 + HCl 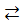 H[SbCl4]
H[SbCl4]
Опыт 3. (под тягой).
В растворы антимонита натрия пропустили ток сероводорода. При этом осадки не выпали. Подкислили эти растворы– выпал оранжевый и красный осадки. В реакции участвуют антимонит и антимонат ионы, а в продуктах ионы сурьмы (III) и (IV). В присутствии ионов водорода идет процесс перехода анионной формы сурьмы в катионную и достижение концентрации для превышения растворимости. Полученные осадки отцентрифугировали, промыли дистиллированной водой и испытали на растворимость в растворе сульфида аммония.
2NaSbO2 + 3H2S + 2HCl = Sb2S3 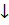 + 2NaCl + 4H2O (оранжевый)
+ 2NaCl + 4H2O (оранжевый)
SbO2- + 3H2S + 2H+ = Sb2S3 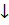 + 4H2O
+ 4H2O
2NaSbO3 + 5H2S + 2HCl = Sb2S5 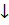 + 2NaCl + 6H2O (тёмно-красный)
+ 2NaCl + 6H2O (тёмно-красный)
SbO3- + 5H2S + 2H+ = Sb2S5 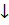 + 6H2O
+ 6H2O
SbO3- + 6H+ 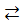 Sb3+ + 3H2O (антимонит)
Sb3+ + 3H2O (антимонит)
SbO5- + 10H+ 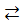 Sb5+ + 5H2O (антимонат)
Sb5+ + 5H2O (антимонат)
Sb2S3 + 3(NH4)2S = 2(NH4)3SbS3 (тиоантимонит)
Sb2S3 + S2- = 2SbS32-
Sb2S5 + 3(NH4)2S = 2(NH4)3SbS4 (тиоантимонат)
Sb2S5 + S2- = 2SbS42-
При окислении.
2(NH4)3SbS3 + 6HCl = Sb2S3 + 6NH4Cl + 3H2S
2SbS32- + 6H+ = Sb2S3 + 3H2S
2(NH4)3SbS4 + 6HCl = Sb2S5 + 6NH4Cl + 3H2S
2SbS42- + 6H+ = Sb2S5 + 3H2S
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|