
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Применение аминов
⇐ ПредыдущаяСтр 3 из 3
Низшие алифатические амины используют для синтеза лекарственных средств, пластмасс и пестицидов.
Анилин — простейший ароматический амин
Анилин (фениламин) C6H5NH2 — родоначальник класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом. Такое строение молекулы анилина имеет важные последствия.
Строение. Неподелённая электронная пара атома азота взаимодействует с л-электронной системой бензольного кольца. Данное взаимодействие можно описать следующими предельными (или резонансными) структурами:
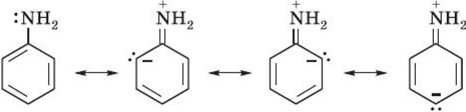 Молекула анилина представляет собой среднее между изображёнными четырьмя структурами.
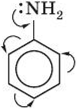
Эти структурные формулы показывают, что электронная пара азота втягивается в бензольное кольцо, при этом на атоме азота создаётся частичный положительный заряд и основные свойства аминогруппы уменьшаются. В бензольном кольце, напротив, электронная плотность увеличивается, причём наиболее сильно — в положениях 2, 4 и 6 (орто- и пара-) к аминогруппе.
Приведённые выше структурные формулы можно объединить в одну, в которой смещение электронной плотности изображено стрелками.
Молекула анилина представляет собой среднее между изображёнными четырьмя структурами.
Эти структурные формулы показывают, что электронная пара азота втягивается в бензольное кольцо, при этом на атоме азота создаётся частичный положительный заряд и основные свойства аминогруппы уменьшаются. В бензольном кольце, напротив, электронная плотность увеличивается, причём наиболее сильно — в положениях 2, 4 и 6 (орто- и пара-) к аминогруппе.
Приведённые выше структурные формулы можно объединить в одну, в которой смещение электронной плотности изображено стрелками.
 Физические свойства
Анилин — бесцветная маслянистая жидкость, немного тяжелее воды, малорастворим в воде, растворяется в этиловом спирте и бензоле.
Получение
Основной способ получения анилина — восстановление нитробензола {реакция Зинина). В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевом или медном катализаторе.
Физические свойства
Анилин — бесцветная маслянистая жидкость, немного тяжелее воды, малорастворим в воде, растворяется в этиловом спирте и бензоле.
Получение
Основной способ получения анилина — восстановление нитробензола {реакция Зинина). В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевом или медном катализаторе. 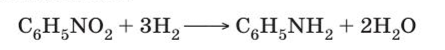 В лаборатории для этой цели используют цинк в кислой среде:
В лаборатории для этой цели используют цинк в кислой среде:
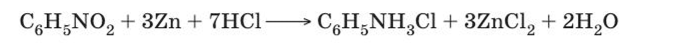 или алюминий в щелочной среде.
или алюминий в щелочной среде.
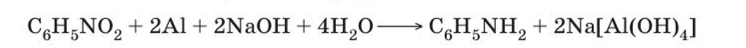 В последних двух реакциях реальный восстановитель — водород в момент выделения.
Химические свойства
1. Анилин — более слабое основание, чем алифатические амины. Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фенил- аммония, которые растворимы в воде, но не растворимы в неполярных органических растворителях.
В последних двух реакциях реальный восстановитель — водород в момент выделения.
Химические свойства
1. Анилин — более слабое основание, чем алифатические амины. Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фенил- аммония, которые растворимы в воде, но не растворимы в неполярных органических растворителях.
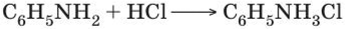 2. Анилин весьма активен в реакциях замещения в бензольном кольце. Это объясняется электронными эффектами (см. строение анилина), которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2, 4, 6-триброманилина.
2. Анилин весьма активен в реакциях замещения в бензольном кольце. Это объясняется электронными эффектами (см. строение анилина), которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2, 4, 6-триброманилина.
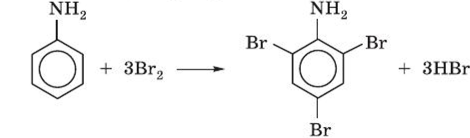 2, 4, 6-триброманилин
3. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(С1)ОС1 на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это качественная реакция на анилин.
Применение
Основная область применения анилина — синтез красителей и лекарственных средств
2, 4, 6-триброманилин
3. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(С1)ОС1 на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это качественная реакция на анилин.
Применение
Основная область применения анилина — синтез красителей и лекарственных средств
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|