
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
водяной пар.
Вода и водяной пар нашли широкое применение в качестве рабочих тел в паровых турбинах тепловых машин, атомных установках и в качестве теплоносителей в различного рада теплообменных аппаратах химико-технологических производств.
Газообразное тело, сосуществующее с кипящей жидкостью называется паром и значительно отличается по своим термодинамическим свойствам от свойств идеального газа.
Парообразованием называется процесс превращения вещества из жидкого состояния в парообразное.
Кипением называется процесс превращения жидкости, кипящей во всем её объеме, в пар при подводе к ней теплоты, а при отводе от пара теплоты происходит обратный процесс – конденсация.
Процессы кипения и конденсации протекают при постоянной температуре и при неизменном давлении, то есть tКП = tН.
Пар, соприкасающейся с жидкостью, из которой он получается и находящейся с ней в термодинамическом равновесии называется насыщенным.
Сухой насыщенный пар – пар, не содержащий в себе жидкость.
Влажным паром называется механическая смесь, состоящая из сухого пара и мельчайших капелек жидкости и характеризуется степенью сухости – Х или степенью влажности – (1 – Х).
Перегретым паром называется пар, полученный из сухого насыщенного пара при подводе к нему при P = Const некоторого количества теплоты и вызванного этим повышением его температуры. Разность между температурами перегретого пара – tП и сухого насыщенного – tН называется степенью перегрева.
До сих пор для реальных газов предложено много уравнений состояния. Однако все они относятся только к ограниченной области состояний. Для технически важных веществ, например, для водяного пара разработаны довольно точные уравнения, с помощью которых рассчитаны параметры и функции состояния в широкой области температур и давлений и сведены в таблицы и на их основе эти характеристики графически представлены в виде диаграмм в P – V, T – S и h – S координатах. Эти диаграммы дают возможность наглядно представить процессы и их энергетические особенности.
Фазовая P – V диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов кипящей воды – v' и сухого насыщенного пара – v" от давления (см. рис. 1. 1).
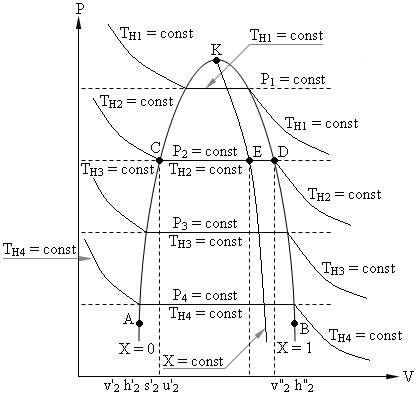
Рис. 1. 1.
График зависимости v' = f(P) представлен на рис. 1. 1 кривой АК, которая называется нижней пограничной кривой или линией кипящей жидкости и характеризуется степенью сухости Х = 0.
График зависимости v" = f(P) представлен на рис. 8. 1 кривой ВК, которая называется верхней пограничной кривой или линией сухого насыщенного пара и характеризуется степенью сухости Х = 1.
Обе кривые АК и ВК делят P – V диаграмму на три части: влево от линии АК – область жидкости; между линиями АК и КВ – двухфазная система, состоящая из смеси кипящей воды и сухого пара – область влажного пара характеризуется степенью сухости 0 < X < 1; вправо от линии КВ и вверх от точки " K" располагается область перегретого пара.
Процесс парообразования в области влажного пара, линия CD, является одновременно изобарным (P = Const) и изотермическим (T = Const).
Обе кривые АК и КВ сливаются в точке К, которая называется критической точкой и характеризуется параметрами: РКР = 221, 29 бар, tКР = 374, 15 °C и vКР = 0, 00326 м3/кг.
В критической точке исчезает различие между жидкостью и паром, выше её существование вещества в двухфазном состоянии невозможно.
Состояние воды и водяного пара аналогичным образом может быть представлено на T – S и h – S диаграммах (см. рис. 1. 2).
T – S диаграмма широко используется при исследовании термодинамических процессов и циклов, так как позволяет видеть изменения температуры рабочего тела и находить количество тепла в процессе. Недостатком данной диаграммы является то, что при определении количества теплоты приходится измерять соответствующие площади.
Достоинством h – S диаграммы является то, что техническая работа и количество тепла в процессах, изображаются отрезками линий.
Решение задач, связанных с состоянием вещества, а также с термодинамическими процессами в области насыщенных и перегретых паров, можно производить или с помощью таблиц воды и водяного пара (см. таблицы № 5 – № 7, № 9 приложения), или с помощью h – S диаграммы. В этих задачах обычно определяются: начальные и конечные параметры пара, изменения внутренней энергии, энтальпии и энтропии, степень сухости, работа и количество теплоты.
Согласно объединённому уравнению первого и второго законов термодинамики:
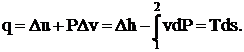 (1. 1)
(1. 1)
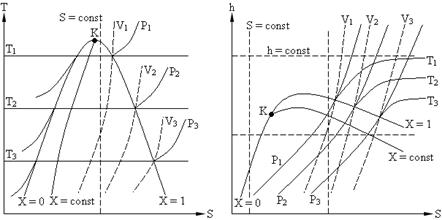
Рис. 1. 2.
В расчетах состояний вещества и процессов в области влажного пара с помощью таблиц используются формулы вида:
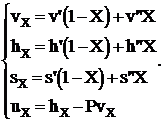 (1. 2)
(1. 2)
Более простым и наглядным, но менее точным, является графический метод расчета процессов по h – S диаграмме, как в области насыщенных, так и в области перегретых паров (см. формулу (1. 1)).
Процессы движения газа, происходящие в различных теплосиловых установках, связаны с преобразованием энергии в газовом потоке.
Уравнение первого закона термодинамики для газового потока при отсутствии сил тяжести и сил трения в газе примет вид:
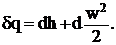 (1. 3)
(1. 3)
При адиабатном течении газа (дq = 0) уравнение (1. 3) после интегрирования будет:
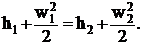 (1. 4)
(1. 4)
Из сравнения уравнений (2. 3) и (1. 3) следует, что для обратимого процесса течение газа:
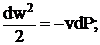 (1. 5)
(1. 5)
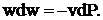 (1. 6)
(1. 6)
Равенство (1. 6) показывает, что при движении рабочего тела по каналу знаки dw и dp противоположны. Если dP > 0, то газ сжимается, а его скорость будет уменьшаться dw < 0 и устройства, в которых такие процессы проходят, называются диффузорами. Если dP < 0, a dw > 0, то такие устройства (каналы) называются соплами.
Из уравнения (1. 4) при условии, что w1 < < w2, можно определить скорость на выходе из канала:
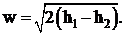 (1. 7)
(1. 7)
Некоторые качественные заключения могут быть сделаны на основании анализа уравнений массового расхода (1. 8) и скорости (1. 7) при стационарном течении газа:
ч = Gv = Fw = const. (1. 8)
Так, для получения максимального расхода газа G, необходимо в уравнение (1. 7) подставить значение располагаемой работы для идеального газа и найти экстремум, в результате чего получается соотношение, называемое критическим и его значение зависит только от свойств газа, и для двухатомных газов оно равно:
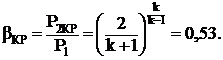 (1. 9)
(1. 9)
Оно показывает, что в суживающемся канале давление газа на выходе не может быть меньше, чем P2 ≥ 0, 53P1, а из этого следует, что скорость газа будет критической, равной местной скорости звука.
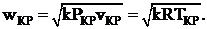 (1. 10)
(1. 10)
Скорость потока газа может быть больше скорости звука (сверхзвуковой) при условии, что P2 < 0, 53P1, если канал будет комбинированный (Сопло Ловаля), состоящий из суживающейся и расширяющейся частей.
В суживающейся части канала поток газа движется с дозвуковой скоростью, в узком сечении скорость равна местной скорости звука и в расширяющейся части она становится сверхзвуковой.
Расчет процесса истечения паров производят, используя h – S диаграмму.
Дросселированием (или мятием) называется необратимый процесс при дq = 0, в котором давление уменьшается при прохождении газа через суживающееся отверстие, а полезной работы не производится.
Уравнение процесса дросселирования получается из уравнения (8. 4) при условии w1 = w2, тогда
h1 = h2. (1. 11)
В процессе дросселирования всегда dP < 0, а dT < или > 0 что следует из анализа уравнения для эффекта Джоуля – Томсона:
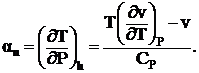 (1. 12)
(1. 12)
и это явление широко используется в холодильной технике.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|