
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Реальный газ
1. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объем. Состояние реального газа часто на практике описывается обобщенным уравнением Менделеева — Клапейрона:
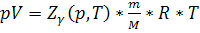 ,
,
где p — давление; T — температура; Zr = Zr (p, T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
2. Межмолекулярное взаимодействие имеет электрическую природу и складывается из сил притяжения (ориентационных, индукционных и дисперсионных) и сил отталкивания.
Межмолекулярное взаимодействие — это взаимодействие между электрически нейтральными молекулами или атомами.
Межмолекулярные взаимодействия, взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекул кристаллов. От Межмолеку- лярных взаимодействий зависят многие структурные, спектральные, термодинамическое, теплофизических и другие свойства веществ. Появление понятия " межмолекулярные взаимодействия" связано с именем Й. Д. Ван-дер-Ваальса, который для объяснения свойств реальных газов и жидкостей предложил в 1873 уравение состояния, учитывающее межмолекулярные взаимодействия, поэтому силы межмолекулярных взаимодействий часто называют ван-дер-ваальсовыми.
Виды межмолекулярных взаимодействий. Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействие между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (ди-польного момента, поляризуемости и др. ). При больших R, значительно превосходящих линейные размеры 1 самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярных взаимодействий можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды межмолекулярных взаимодействий можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на некоторую условность, такое деление в каждом конкретном случае позволяет объяснять природу межмолекулярных взаимодействий и рассчитать его энергию.
Энергия электростатическоговзаимодействия Vэл-ст представляет собой энергию кулоновского взаимодействия, вычисленную в предположении, что распределение зарядовой плотности отвечает изолированным молекулам (R =∞ ). В общем случае электрический потенциал вокруг молекулы изменяется не только по абсолютной величине, но и по знаку. Если взаимная ориентация двух молекул такова, что область положительного потенциала одной из них приблизительно совпадает с областью, в которой локализован отрицательный заряд другой, то Vэл-ст < 0, т. е. электростатичное взаимодействие молекул ведет к их притяжению. При R> > 1энергия Vэл-ст становится равной сумме энергий взаимодействий мультиполей (диполей, квадруполей и т. д. ); для полярных молекул главный вклад дает обычно диполь-дипольное взаимодействие. Его энергия Vдип-дип может иметь разный знак в зависимости от ориентации диполей. При ориентации молекул А и В, соответствующей минимуму энергии взаимодействие, Vдип-дип = — 2pApB/R3, где pА и рB - дипольные моменты молекул А и В соответственно. В газовой фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные ориентации, которые отвечают притяжению диполей. [1]-Химическая энциклопедия. И. Л. Кнунянц, том 3, с. 150
3. Предпринималось много попыток для учета отклонений свойств реальных газов от свойств идеального газа путем введения различных поправок в уравнение состояния идеального газа. Наибольшее распространение вследствие простоты и физической наглядности получило уравнение Ван-дер-Ваальса (1873).
Первая поправка в уравнении состояния идеального газа рассматривает собственный объем, занимаемый молекулами реального газа. В уравнении Дюпре (1864):
p (V – nb) = nRT
постоянная b учитывает собственный мольный объем молекул.
При понижении температуры межмолекулярное взаимодействие в реальных газах приводит к конденсации (образование жидкости). Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления π (иногда его называют статическим давлением). Изначально величина π была учтена в общей форме в уравнении Гирна (1865):
(p + π ) (V – nb) = nRT
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
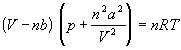 (1)
(1)
или для одного моля
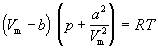 (2)
(2)
Второе уравнение можно переписать так, чтобы выразить в явном виде давление
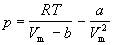
или объем:
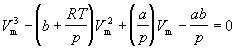
Принципиальное значение уравнения Ван-дер-Ваальса определяется следующими обстоятельствами:
1) уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p, V, T), описывающей свойства реальных газов;
2) уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния;
3) с помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме.
Причиной недостаточной точности уравнения Ван-дер-Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных. После 1873 г. сам Ван-дер-Ваальс предложил еще шесть вариантов своего уравнения, последнее из которых относится к 1911 г. и содержит пять эмпирических постоянных. Две модификации уравнения (1) предложил Клаузиус, и обе они связаны с усложнением вида постоянной b. Больцман получил три уравнения этого типа, изменяя выражения для постоянной a. Всего известно более сотни подобных уравнений, отличающихся числом эмпирических постоянных, степенью точности и областью применимости. Выяснилось, что ни одно из уравнений состояния, содержащих менее 5 индивидуальных постоянных, не оказалось достаточно точным для описания реальных газов в широком диапазоне p, V, T, и все эти уравнения оказались непригодными в области конденсации газов.
4. Уравнение Клапейрона-Менделеева достаточно хорошо описывает газ при высоких температурах и низких давлениях, когда он находится в условиях достаточно далёких от условий конденсации. Однако для реального газа это не всегда выполняется и тогда приходится учитывать потенциальную энергию взаимодействия молекул газа между собой. Простейшим уравнением состояния, описывающим неидеальный газ, является уравнение, предложенное в 1873 г. Иоханнесом Дидериком Ван-дер-Ваальсом (1837 - 1923)
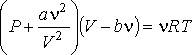 (1)
(1)
где:  ,
,  и
и 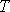 - давление, объём и температура газа,
- давление, объём и температура газа,  -количество молей газа,
-количество молей газа,  и
и 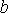 - постоянные для данного газа. Для различных газов постоянные
- постоянные для данного газа. Для различных газов постоянные  и
и 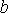 различны, и их можно определить экспериментально. Значение константы
различны, и их можно определить экспериментально. Значение константы 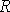 такое же, как и для идеального газа. Такой вид уравнения состояния реального газа имеет как экспериментальные, так и молекулярно-кинетические обоснования. Остановимся сначала на последних.
такое же, как и для идеального газа. Такой вид уравнения состояния реального газа имеет как экспериментальные, так и молекулярно-кинетические обоснования. Остановимся сначала на последних.
Пусть на молекулы газа действуют силы притяжения и отталкивания. И те, и другие силы действуют на небольших расстояниях, но силы притяжения убывают медленнее сил отталкивания. Силы притяжения относятся к взаимодействию молекулы с её ближайшим окружением, а сила отталкивания - проявляется в момент столкновения двух молекул.
Силы притяжения внутри газа в среднем скомпенсированы для каждой отдельной молекулы. На молекулы, расположенные в тонком слое вблизи стенки сосуда, действует сила притяжения со стороны других молекул, направленная внутрь газа, которая создает давление, добавочное к создаваемому самой стенкой. Это давление иногда называют внутренним давлением.
Суммарная сила внутреннего давления, действующая на элемент поверхностного слоя газа должна быть пропорциональна числу молекул газа в этом элементе и также числу молекул в слое газа, непосредственно примыкающему к рассматриваемому элементу поверхностного слоя. Толщина этих слоёв определяется радиусом действия сил притяжения и имеет тот же порядок величины. При увеличении концентрации молекул газа в  раз, сила притяжения, приходящаяся на единицу площади приповерхностного слоя, возрастёт в
раз, сила притяжения, приходящаяся на единицу площади приповерхностного слоя, возрастёт в 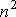 раз. Поэтому величина внутреннего давления растёт пропорционально квадрату концентрации молекул газа. Тогда для суммарного давления внутри газа
раз. Поэтому величина внутреннего давления растёт пропорционально квадрату концентрации молекул газа. Тогда для суммарного давления внутри газа 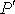 можно записать:
можно записать:
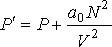 (2)
(2)
где:  - давление газа, которое действует на стенку сосуда (по третьему закону Ньютона стенка действует на газ с тем же давлением),
- давление газа, которое действует на стенку сосуда (по третьему закону Ньютона стенка действует на газ с тем же давлением), 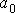 - постоянная, определяемая физико-химическими характеристиками молекул газа,
- постоянная, определяемая физико-химическими характеристиками молекул газа, 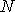 - число молекул газа в объеме
- число молекул газа в объеме  . Отношение
. Отношение 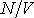 представляет собой концентрацию молекул газа. Величина
представляет собой концентрацию молекул газа. Величина  - это давление, которое создавал бы идеальный газ при тех же условиях.
- это давление, которое создавал бы идеальный газ при тех же условиях.
Вводя обозначение:
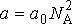 (3)
(3)
где: 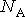 - постоянная Авогадро, имеем
- постоянная Авогадро, имеем
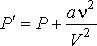 (4)
(4)
Итак, нами получен вид поправки к давлению, которая необходима для того, чтобы учесть слабые силы притяжения в реальном газе, отличающие его от идеального. При этом в формуле для нахождения суммарного давления внутри газа  появилась новая постоянная
появилась новая постоянная  , зависящая от свойств газа.
, зависящая от свойств газа.
Рассмотрим теперь поправку, связанную с действием сил отталкивания. Поскольку нами будут учитываться только парные взаимодействия между молекулами, то эта сила, в отличие от силы притяжения, не будет зависеть от концентрации молекул. По этой же причине сила отталкивания проявляется во всём объёме газа, а не только в приповерхностном слое. Зависимость этой силы от расстояния между молекулами определяет эффективное сечение взаимодействия молекул, то есть, по сути, их размеры.
Таким образом, в случае проявления короткодействующих сил отталкивания, невозможно аппроксимировать молекулы материальными точками и пренебречь их размерами. Поэтому необходимо ввести поправку, учитывающую объём, занимаемый молекулами. Её величина будет пропорциональна общему числу молекул 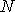 , а также зависеть от их физико-химических свойств. Тогда свободный от молекул объем
, а также зависеть от их физико-химических свойств. Тогда свободный от молекул объем 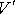 можно определить следующим образом:
можно определить следующим образом:
 (5)
(5)
где: 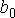 - коэффициент, определяемый свойствами молекул. Вводя обозначение:
- коэффициент, определяемый свойствами молекул. Вводя обозначение:
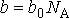 (6)
(6)
представим формулу (5) в виде:
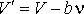 (7)
(7)
Величину 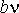 и, таким образом, величину эффективного объёма, занимаемого молекулами, нельзя получить из простых механических моделей, так как сами размеры молекул определяются характером сил отталкивания. Поскольку уравнение Ван-дер-Ваальса является по сути своей эмпирическим, коэффициент
и, таким образом, величину эффективного объёма, занимаемого молекулами, нельзя получить из простых механических моделей, так как сами размеры молекул определяются характером сил отталкивания. Поскольку уравнение Ван-дер-Ваальса является по сути своей эмпирическим, коэффициент 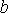 , так же как и коэффициент
, так же как и коэффициент  , должны определяться в первую очередь экспериментально.
, должны определяться в первую очередь экспериментально.
Если теперь в левой части уравнения Клапейрона-Менделеева:
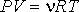
произвести замену произведения 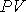 на произведение
на произведение
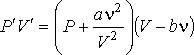
то получится уравнение Ван-дер-Ваальса.
Введение поправки, обусловленной действием сил притяжения, привело к тому, что уравнение состояния стало кубическим относительно объёма, а число постоянных, являющихся его параметрами, стало равным трем. Как известно, кубическое уравнение имеет три корня. Для уравнения Ван-дер-Ваальса имеют место два следующих случая: а) корни действительны; б) два корня мнимые и один корень действительный.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|