
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Занятие № 6 (09.10-13.10) 1. Защита темы (модуля) «Основные закономерности протекания химических реакций (химическая термодинамика, химическая кинетика и равнове
Занятие № 6 (09. 10-13. 10) 1. Защита темы (модуля) «Основные закономерности протекания химических реакций (химическая термодинамика, химическая кинетика и равнове
2 Модуль «Растворы. Протолитические и гетерогенные равновесия. Окислительно-восстановительные процессы
Тема: «Вода как универсальный биорастворитель. Коллигативные свойства растворов».
Защита темы (модуля) «Основные закономерности протекания химических реакций (химическая термодинамика, химическая кинетика и равновесие.
Повторите учебный материал занятий модуля
Вопросы к защите модуля: «Основы химической термодинамики, химической кинетики и равновесия»
Теоретические вопросы.
1. Основные понятия химической термодинамики:
1. 1Система, системы гомогенные и гетерогенные, системы открытые, закрытые и изолированные;
1. 2Параметры системы: интенсивные, экстенсивные, функции состояния;
1. 3Состояние системы равновесное, стационарное, переходное;
1. 4Термодинамические процессы: изобарические, изохорические, изотермические;
1. 5Внутренняя энергия, работа, теплота, связь между ними.
2. I начало термодинамики: определение, математическое выражение для изолированных и закрытых систем, биологическое значение.
3. Закон Гесса: формулировка, определение теплового эффекта реакции по энтальпиям образования и энтальпиям сгорания; значение для термохимических расчетов.
4. Энтальпия реакции, процессы экзо- и эндотермические; стандартные энтальпии образования простых и сложных веществ. Энтальпия сгорания.
5. Энтропия: определение, смысловое значение, факторы, влияющие на ее величину; определение DS° в химических реакциях при с. у.
6. II закон термодинамики: сущность, формулировка, математическое выражение для изолированных систем.
7. Энергия Гиббса как обобщенная термодинамическая функция, ее применение для прогнозирования возможности и предела самопроизвольного протекания процессов.
8. Основные понятия химической кинетики:
8. 1 реакции гомогенные, гетерогенные, математическое выражение скорости гомогенных и гетерогенных реакций, скорость средняя и истинная, единицы измерения, примеры;
8. 2 реакции простые и сложные: последовательные, параллельные, последовательно-параллельные, циклические, примеры;
8. 3 факторы, влияющие на скорость гомогенных реакций: природа, концентрация реагентов, температура, катализаторы;
8. 4 закон действующих масс, кинетические уравнения реакций, физический смысл константы скорости реакции; привести кинетические уравнения для следующих реакций:
NO(г) + O2 (г) ® NO2(г); С(тв) + СО2 (г) ® СО (г);
8. 5 понятие о молекулярности и порядке реакции, определить молекулярность и порядок следующих реакций, допуская, что данные уравнения отражают механизм реакции:
N2(г) + 2O2(г) ® 2NO2(г); CO(г) + Cl2(г) ® COCl2 (г);
CH3COOC2H5 (р-р) + H2O(ж)®CH3COOH (р-р)+C2H5OH(р-р); CaCO3(тв) ® CaO(тв)+CO2 (г).
8. 6 Энергия активации, ее значение, факторы, влияющие на величину энергии активации, связь с константой скорости реакции – уравнение Аррениуса.
9. Катализ, катализаторы, общие принципы катализа.
10 Суть механизма гомогенного катализа, примеры. Понятие о кислотно-основном катализе.
11. Особенности механизма гетерогенного катализа, примеры.
12. Ферментативный катализ и его особенности: активность, специфичность, размер, необходимость определенных условий. Уравнение Михаэлиса – Ментен, его значение для кинетики ферментативных реакций.
13. Химическое равновесие и его смещение, принцип Ле–Шателье.
14. Константа химического равновесия, способы ее выражения, факторы, влияющие на ее величину, связь с DG, значение для характеристики обратимых процессов. Использование уравнения изотермы в термодинамических расчетах.
Упражнения и задачи к защите модуля
1. В организме человека этанол окисляется в две стадии: до уксусного альдегида (DНо = –256 кДж/моль), а затем до уксусной кислоты (DНо = –237 кДж/моль). На основании закона Гесса рассчитайте энтальпию окисления этанола до уксусной кислоты. Сформулируйте закон Гесса.
2. Стандартная энтальпия растворения сульфата меди равна – 66, 5 кДж/моль; стандартная энтальпия гидратации до пентагидрата равна –78, 22 кДж/моль. Вычислите стандартную энтальпию растворения пентагидрата. Что называют энтальпией растворения.
3. Рассчитайте тепловой эффект реакции спиртового брожения глюкозы: С6Н12О6 ®2С2Н5ОН+2СО2, используя стандартные энтальпии сгорания. Дайте определение стандартной теплоте сгорания.
4. Используя стандартные энтальпии образования вычислите, сколько теплоты выделится при разложении 54 г глюкозы по реакции: С6Н12О6(к) ® 2С2Н5ОН(ж) + 2СО2(г). Дайте определение лонятию стандартная теплота образования простых и сложных веществ.
5. Определите калорийность 350 г пищевого продукта, содержащего 50% воды; 30% белка, 15% жиров, 5% углеводов. Что такое калорийность?
6. Сравните свободную энергию Гиббса для реакций окисления a-D-глюкозы при 25оС:
С6Н12О6(р-р) ® 2С2Н5ОН(ж) + 2СО2(г); С6Н12О6(р-р) + О2(г) ® 6СО2(г) + 6Н2О(ж). Какой процесс является более эффективным с точки зрения использования a-D-глюкозы?
7. Сделать заключение о практической обратимости реакции гидролиза глицил-глицина при 310 К, рассчитав константу равновесия, если DG 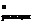 = –15, 08 кДж/моль.
= –15, 08 кДж/моль.
8. При 300 К константа равновесия реакции: L-глутаминовая кислота + пируват a-кетоглутаровая кислота + L-аланин равна 1, 11. В каком направлении будет идти реакция при следующих концентрациях: [L-глутаминовая кислота] = [пируват] = 3× 10–5 моль/л; [a-кетоглутаровая кислота] = [L-аланин] = 5× 10–3 моль/л. Практическое значение уравнения изотермы Вант-Гоффа.
9. Равновесие реакции: Н2(г) + I2(г) 2HI(г) установилось при следующих концентрациях реагирующих веществ в моль/л: [H2] = 0, 25; [I2] = 0, 05; [HI] = 0, 9. Вычислите константу равновесия и исходные концентрации водорода и иода. Укажите термодинамическое и кинетическое условие химического равновесия.
10. Опираясь на знание принципа Ле-Шателье, ответьте, как и почему повлияет на равновесную концентрацию хлора в системе: 4HCl(г) + O2(г) 2Н2О(г) + 2Cl2(г), DНо > 0 а) понижение давления; б) увеличение концентрации HCl; в) увеличение температуры.
11. Константа скорости распада пеницилина при 36оС равна 6× 10–6 с–1, а 41оС – 1, 2× 10–5 с–1. Вычислите температурный коэффициент реакции. Сформулируйте правило Вант-Гоффа.
12. Во сколько раз уменьшится скорость окисления глюкозы при гипертермии, если температура тела падает от 36, 6оС до 27оС, а температурный коэффициент данной реакции равен 1, 3? Что такое температурный коэффициент? Какой величины он может достигать в ферментативных процессах?
13. Одним из опасных последствий ядерных взрывов является образование стронция-90 и его внедрение в кости вместо кальция. Период полупревращения этого элемента 28 лет. Предположим, что 1 мкг стронция-90 поглощен новорожденным. Сколько останется его к 18 годам? (Распад стронция-90 является реакцией первого порядка).
14. Константа скорости реакции: (СН3СОО)2О + Н2О ® 2СН3СООН при 15оС равна 0, 0454 мин–1. Исходная концентрация уксусного ангидрида была равна 0, 5 моль/л. Чему будет равна скорость реакции в тот момент, когда концентрация уксусной кислоты станет равной 0, 1 моль/л? Дайте определение истинной и средней скорости реакции.
15. Вычислите энергию активации реакции спиртового брожения глюкозы, если температурный коэффициент реакции в интервале температур 30оС–70оС равен 2. Дайте определение энергии активации
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|