
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЛАБОРАТОРНАЯ РАБОТА №3. ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ РАСТВОРЕНИЯ МАГНИЯ В КИСЛОТЕ
ЛАБОРАТОРНАЯ РАБОТА №3. ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ РАСТВОРЕНИЯ МАГНИЯ В КИСЛОТЕ
Цель работы
Определить теплоту растворения металлического магния Mg в растворе соляной кислоты HCl
| Наименование | Ед. изм | Кол-во |
| Оборудование | ||
| Учебно-лабораторный модуль «ТЕРМОДИНАМИКА» | шт. | |
| Сетевой кабель | шт. | |
| Платиновый термометр сопротивления | шт. | |
| Соединительный кабель для датчика | шт. | |
| Магнитная мешалка | шт. | |
| Калориметр | шт. | |
| Реактивы | ||
| Стружка Mg | г | |
| Водный раствор HCl, 0, 1 моль/л | мл | |
| Посуда | ||
| Стакан на 100 мл | шт. | |
| Колба мерная 100 мл | шт. | |
| Груша | шт. | |
| Пипетка мерная 10 мл | шт. | |
| Промывалка с дистиллированной водой | шт. | |
| Воронка лабораторная В- 56-80 | шт. | |
ПОРЯДОК ПРОВЕДЕНИЯ РАБОТЫ
Опыт №1. Определение постоянной калориметра
Постоянную калориметра берут из лабораторной работы №1 или определяют заново по методике из вышеуказанной работы.
Опыт №2. Растворение магния в кислоте
Наливают в стакан 100 мл 0, 1 н HCIи устанавливают в калориметр, устанавливают скорость мешалки 5.
Выбирают режим Кинеутика и 600 измерений каждую секунду, через 300 измерений вносят 0, 05-0, 2 г металлического магния.
Опыт повторяют три раза, вычисляют относительную погрешность измерений.
Далее графически определяют изменение температуры и рассчитывают энтальпию взаимодействия кислоты с магнием.
Пример оформления отчета
1. Приготовление 300 мл 0, 1 н HCI.
Так как ближайшая мерная посуда это колба на 500 мл, то расчет будем производить исходя из этого объема. Рассчитаем объем аликвоты кислоты.
Для приготовления заданного объема кислоты требуется
n=0, 5·0, 1=0, 05 моль HCI,
m=n·M=0, 05·36, 23= 1, 81 г HCI
Так как соляная кислота является раствором HCl в воде, то воспользуемся таблицей зависимости плотности кислоты от содержания HCl. Плотность кислоты указана на упаковке или может быть измерена экспериментально. Возьмем для расчета При плотности соляной кислоты 1, 18 г/см3, содержание HCl 427, 7 г/л, значит объем кислоты, которую надо отобрать из банки для приготовления раствора заданной концентрации
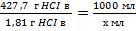 ,
,
Х=1, 81*1000/427, 7=4, 23 мл.
Для приготовления 500 мл рHCl, 0, 1 моль/л нужно взять 4, 23 мл кислоты плотностью 1, 18 г/см3, поместить в мерную колбу на 500 мл и довести до метки водой.
2. Растворение навески магния.
Проведем растворение навески магния.
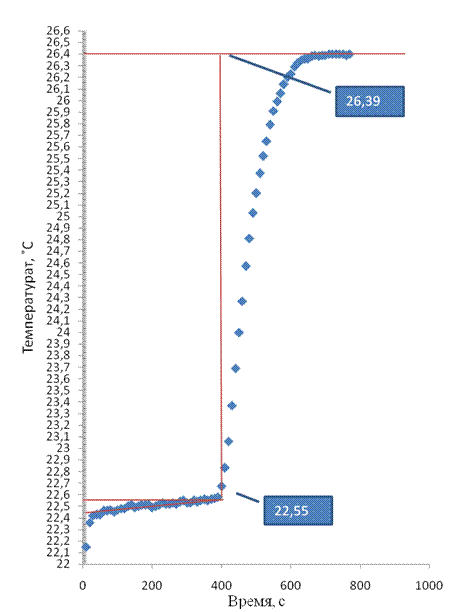
|
| Рисунок 1 – Термограмма растворения магния в соляной кислоте |
| № | Параметр | Номер опыта | ||
| 3. | Мметалла, г | |||
| 4. | t1, ˚ С | 23, 1 | 22, 55 | 23, 3 |
| 5. | t2, ˚ С | 27, 5 | 26, 39 | 27, 2 |
| 6. | dt | -4, 4 | -3, 84 | -3, 9 |
| 7. | С | 4, 18 | 4, 18 | 4, 18 |
| 8. | К | |||
| 9. | mкислоты, г | |||
| 10. | mмагния, г | 0, 12 | 0, 09 | 0, 09 |
| 11. | Qуд, Дж | -1973 | -1722 | -1749 |
| 12. | Q, кДж/кг | -16445 | -19131 | -19430 |
| 13. | Q, кДж/моль | -444 | -459 | -466 |
| 14. | Qср., кДж/моль | -456, 3 | ||
| 15. | Qтабл, кДж/моль | -460 | ||
| 16. | Относительная погрешность, % | 0, 80 | ||
Критерии оценивания лабораторной работы в зависимости от полученной относительной погрешности
| Рекомендуемая оценка, балл | |||
| Погрешность, % | < 3 | 3, 1-5 | > 5 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|