
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Отдельные представители. Многоатомные спирты
Отдельные представители
Метиловый спирт – СН3ОН сильно ядовит. В то же время он используется как растворитель, как сырье для получения формальдегида, им денатурируют этиловый спирт и применяют как горючее. Легко воспламеняется, Твсп. = 8оС. Пары спирта с воздухом образуют взрывоопасные смеси. При контакте с сильными окислителями (дымящаяся HNO3, CrO3 и Na2O2) метанол самовозгорается.
Этиловый спирт (этанол, винный спирт). Бесцветная жидкость с характерным запахом и жгучим вкусом. Используется при получении каучуков, а также как растворитель, в парфюмерии (духи, одеколоны), горючее, дезинфицирующее средство, алкогольный напиток, на его основе готовят лекарства. Легко воспламеняется –Твсп. =13 оС.
Многоатомные спирты
Двухатомные спирты называются гликолями, трехатомные – глицеринами.
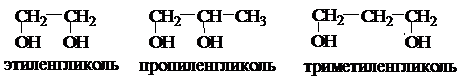
Среди двухатомных спиртов этиленгликоль представляет наибольший интерес. В огромных количествах его используют в качестве антифриза для охлаждения цилиндров автомобильных, тракторных и авиационных двигателей; при получении лавсана (полиэфир этиленгликоля с терефталевой кислотой). Этиленгликоль – бесцветная сиропообразная горючая жидкость, не имеющая запаха, сладкая на вкус, ядовита. Смешивается с водой и этанолом в любых соотношениях. Ткип. =197 оС, Тпл. = —13 оС, d420=1, 114 г/см3. Дает все реакции, характерные для одноатомных спиртов, причем в них может участвовать одна или обе спиртовые группы. Но в отличие от одноатомных спиртов они растворяют гидроксиды тяжелых металлов. Например, при приливании этиленгликоля к голубому студенистому осадку Cu(OH)2 образуется синий раствор гликолята меди:
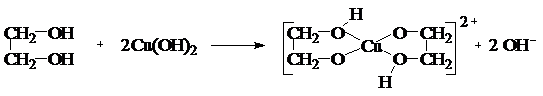
Глицерин. В природе в свободном виде почти не встречается, но широко распространены его производные – сложные эфиры с высшими карбоновыми кислотами (жиры и масла), которые имеют большое биологическое и практическое значение. Сам глицерин используется в парфюмерии, фармации, в текстильной и пищевой промышленности, для получения нитроглицерина и т. д.
Глицерин – бесцветная, вязкая и горючая жидкость, без запаха, сладкая на вкус, не ядовита. Очень гигроскопичен, смешивается с водой и этанолом в любых пропорциях. Ткип. 290 оС (с разложением), d420=1, 26 г/см3. Ткип, плотность и вязкость глицерина более высокие, чем у одноатомных спиртов, т. к. он образует больше водородных связей. Это же ведет к более высокой гигроскопичности и растворимости в воде. Глицерин нельзя хранить рядом с сильными окислителями, контакт с которыми приводит к возникновению пожара. Например, взаимодействие с KMnO4, Na2O2, приводит к самовоспламенению глицерина.
При взаимодействии глицерина с азотной кислотой в присутствии Н2SO4 идет следующая реакция:
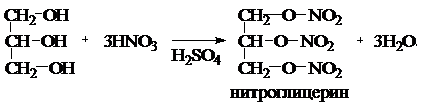
Нитроглицерин – тяжелое масло (d15= 1, 601 г/см3), не растворимое в воде, но хорошо растворимое в спирте и других органических растворителях. При охлаждении кристаллизуется (Тпл. =13 оС), очень ядовит. Нитроглицерин – сильное взрывчатое вещество. Впервые его производство для военных целей организовал Альфред Нобель, заработав себе колоссальное состояние. При ударе и детонации нитроглицерин мгновенно разлагается с выделением огромного количества газов:
4С3Н5(ОNO2)3 ® 12СО2 + 6N2 + О2 + 10Н2О.
Для обеспечения безопасности при проведении взрывных работ его используют в виде так называемого динамита – смеси, состоящей из 75 % нитроглицерина и 25 % инфузорной земли (горная порода из кремнистых оболочек диатомовых водорослей). Спиртовый раствор нитроглицерина (1% мас. ), не обладающий взрывчатыми свойствами, применяют в качестве сосудорасширяющего средства при лечении болезней сердца.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|