
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Спирты. Физические свойства
Спирты
Спиртами называются производные углеводородов, представляющие собой продукты замещения атома (атомов) водорода на гидроксильную группу – ОН. В зависимости от того, какое количество атомов водорода замещено, спирты бывают одноатомными и многоатомными.
Наибольшее значение имеют предельные одноатомные спирты, состав которых может быть выражен общей формулой — СnH2n+1ОН или R-OH.
Несколько первых членов гомологического ряда спиртов и их названия по радикально-функциональной, заместительной и рациональной номенклатурам приведены ниже:
CH3OH метиловый метанол карбинол
спирт
C2H5OH этиловый этанол метилкарбинол
спирт
н-С3Н7ОН пропиловый пропан-1-ол этилкарбинол
спирт
н-С4Н9ОН бутиловый бутан-1-ол пропилкарбинол
спирт
н-С5Н11OН амиловый пентан-1-ол бутилкарбинол
спирт
По радикально-функциональной номенклатуре название спиртов образуется из названия радикалов и слова «спирт», выражающего функциональное название класса, например, этиловый спирт. Международная IUPAC- номенклатура: к тривиальному названию углеводорода, производным которого является спирт, добавляют окончание –ол (алканолы).
Изомерия предельных одноатомных спиртов обусловлена строением углеродного скелета и положением ОН- группы. Метиловый и этиловый спирты не имеют изомеров.
Физические свойства
Газов в гомологическом ряду спиртов нет. Низшие спирты – подвижные жидкости, начиная с С12Н25ОН до С20Н41ОН – маслообразные, а с С21Н43ОН — твердые вещества. Ткип их значительно выше, чем углеводородов с тем же числом С-атомов: ТкипСН3ОН = 65 °С, Ткип С2Н5ОН = 78 °С (ТкипСН4 = –164, 5 °С, Ткип С2Н6 = –88, 6 °С). Первичные спирты изостроения имеют более низкие температуры кипения, чем нормальные первичные спирты. Более высокие Ткип спиртов обусловлены ассоциацией их молекул друг с другом за счет образования межмолекулярной водородной связи (см. лекция 2). Поэтому метанол – жидкость, а метан – газ. Чтобы разрушить водородные связи, надо затратить энергию, напр. нагреть. Спирты легче воды: их плотности меньше 1, 0 (плотность этанола 0, 8 г/см3). Метиловый, этиловый и пропиловый спирты смешиваются с водой во всех соотношениях. По мере увеличения и усложнения углеводородных радикалов растворимость спиртов уменьшается. Бутиловый спирт растворяется частично. Высшие спирты в воде не растворяются, т. е. выталкиваются из воды.
Химические свойства. Спирты реагируют со щелочными металлами (Na, K и т. д. ) с образованием алкоголятов:
2R—OH + 2Na ® 2R—ONa + H2.
Реакция протекает не так бурно, как с водой. Причем с увеличением молярной массы спирта его активность в указанной реакции уменьшается.
Взаимодействие спиртов с кислотами называют реакцией этерификации. В результате этерификации образуются сложные эфиры:
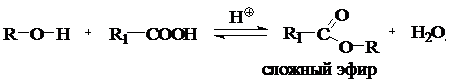
Дегидратация спиртов под действием водоотнимающих средств (H2SO4):
- внутримолекулярная
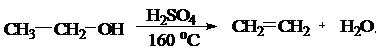
- межмолекулярная
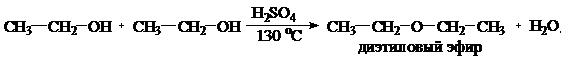
Видно, что результат реакции зависит от условий ее проведения.
Окисление спиртов кислородом воздуха возможно при высокой температуре с образованием СО2 и Н2О (процесс горения). Метанол и этанол горят почти бесцветным пламенем, высшие – более ярким коптящим. Это связано с увеличением относительного содержания углерода в молекуле.
Кислые растворы KMnO4 и K2Cr2O7 окисляют первичные спирты до альдегидов. При этом малиновый раствор KMnO4 обесцвечивается, а оранжевый раствор K2Cr2O7 становится зеленым [Cr2(SO4)3].
Дальнейшее окисление альдегидов приводит к получению карбоновых кислот:
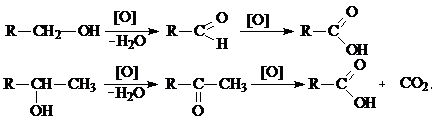
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|