
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
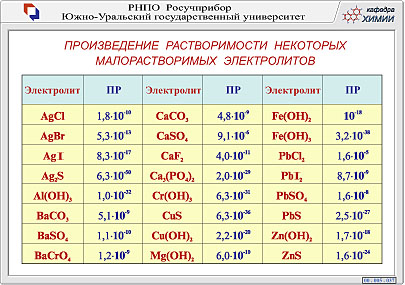
При установившемся равновесии скоростей осаждения и растворения осадка в насыщенном растворе малорастворимого электролита при данной температуре и давлении произведение концентраций (активностей) его ионов есть величина постоянная и называется произведени
При установившемся равновесии скоростей осаждения и растворения осадка в насыщенном растворе малорастворимого электролита при данной температуре и давлении произведение концентраций (активностей) его ионов есть величина постоянная и называется произведение растворимости ПР
Выражение для константы ПР определяется составом электролита и его электролитической диссоциацией на ионы. В общем случае для плохо растворимого сильного электролита, диссоциация которого осуществляется по уравнению:
AnBm  nAm+ + mBn-.
nAm+ + mBn-.
Выражение для константы ПР записывается по следующей форме:
ПР AnBm = [Am+]n ·[Bn-]m,
где
[Am+] и [Bn-] – равновесные молярные концентрации соответствующих катионов и анионов в насыщенном растворе;
n, m – коэффициенты, показывающие число соответствующих ионов, образующихся при электролитической диссоциации формульной единицы электролита.
Например, для ортофосфата кальция:
Ca3(PO4)2  3 Ca2+ + 2 PO43- (уравнение диссоциации)
3 Ca2+ + 2 PO43- (уравнение диссоциации)
ПРCa3(PO4)2 = [Ca2+]3 · [PO43-]2.
По величине константы произведение растворимости (ПР) можно рассчитать:
-концентрации ионов в насыщенных растворах,
-изменение концентрации одних ионов в зависимости от изменения концентрации других ионов,
- делать предварительные выводы о выпадении, не выпадении или растворении осадков, о влиянии одноимённых ионов.
Обычно величины ПР могут быть вычислены по данным растворимостей (S), найденным экспериментальным путём. И, наоборот, по величине ПР рассчитывают растворимость плохо растворимых сильных электролитов.
Растворимость - это концентрация насыщенного раствора при данной температуре. Она может быть выражена молярной концентрацией растворенного вещества (моль/л) в насыщенном растворе либо массой (г) растворенного вещества в 1 л насыщенного раствора, либо массой растворенного вещества (г), необходимой для насыщения 100 г растворителя.
Рассмотрим расчёт растворимости по величине ПP на следующих примерах.
Пример 1 . Определить растворимость в воде сульфата бария (BaSO4) в моль/л и в г/л.
ПРBaSO4 =1, 1*10-10
Решение.
BaSO4  Ba2+ + SO42- (уравнение диссоциации)
Ba2+ + SO42- (уравнение диссоциации)
S моль/л S моль/л S моль/л
ПРBaSO4 = [Ba2+] * [SO42-] = 1, 1*10-10 .
Если в 1 л растворилось S моль/л BaSO4, то концентрации ионов в соответствии с уравнением диссоциации равны:
[Ba2+] = [SO42-] = S (моль/л). Подставим это значение в выражение для ПРBaSO4 и получим уравнение с одним неизвестным: ПРBaSO4 = S2.
Следовательно, S = [ПРBaSO4 ]1/2 = [1, 1*10-10 ]1/2 = 1, 05*10-5 моль/л.
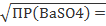
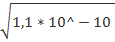 = = 1, 05*10-5 моль/л.
= = 1, 05*10-5 моль/л.
Расчет массы BaSO4 в 1 л насыщенного раствора (растворимости в г/л) осуществляем по соотношению
СBaSO4= S*M(BaSO4) = 1, 05*10-5*233= 2, 45·10-3 г/л.
Пример 2. Вычислить растворимость (моль/л) в воде Ca3(PO4)2, если ПРCa3(PO4)2= 3*10-33.
Решение.
Ca3(PO4)2  3 Ca2+ + 2 PO43- (уравнение диссоциации)
3 Ca2+ + 2 PO43- (уравнение диссоциации)
S моль/л 3S моль/л 2S моль/л
В соответствии с уравнением диссоциации, если S моль/л Ca3(PO4)2 растворилось в 1 л, концентрации ионов равны: [Ca2+] = 3S и [PO43-] = 2S.
Подставляем эти значения в выражение для ПРCa3(PO4)2, и решаем уравнение с одним неизвестным:
ПРCa3(PO4)2 = [Ca2+]3 * [PO43-]2
3 *10-33. =; (3S)3·* (2S)2
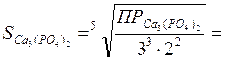
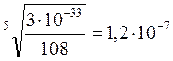 моль/л.
моль/л.
Любое соединение, образующее раствор, может быть насыщенным или ненасыщенным. Первым называют взаимодействие при определённой температуре, когда можно растворить ещё какую-то часть продукта, а вторым — раствор, в котором скорости реакции и осаждения равны. Существует и третий вид раствора — перенасыщенный. Это состояние реакции, при которой образуется осадок.
Эти три состояния можно описать формулами:
ПР АВ = [A+]*[B-] - насыщенное соединение;
ПР АВ > [A+]*[B + ] - ненасыщенный раствор;
ПР АВ < [Ag+]*[B-] - перенасыщенная смесь.
Насыщенные растворы слаборастворимых ионов характеризуются произведением растворимости. Поэтому условием образования осадка будет увеличение произведения концентраций электролита в малорастворимом растворе над его произведением растворимости.
1. Контрольные вопросы
1. Какие процессы происходят в системе, состоящей из осадка трудно растворимого электролита и раствора над ним?
2. Какое состояние устанавливается в системе, состоящей из осадка трудно растворимого электролита и раствора над ним?
3. Дайте формулировку правила произведения растворимости.
4. Напишите выражение ПР в общем виде.
5. Напишите выражение ПР для сульфата бария и фосфата кальция.
6. Какое неравенство характеризует пересыщенный раствор сульфата бария?
7. Какое неравенство характеризует ненасыщенный раствор карбоната кальция?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|