
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Равновесие в системе «осадок-раствор». Произведение растворимости
Тема:
Равновесие в системе «осадок-раствор». Произведение растворимости
В аналитической практике часто используются гетерогенные (неоднородные) системы, состоящие из двух и более фаз, например, реакции осаждения.
Особенность реакций осаждения заключается в том, что в результате растворения образуется новая фаза – твердое вещество и возникает гетерогенная двухфазная система: раствор – осадок (существует равновесие между осадком, образующимся при осаждении, и раствором, соприкасающимся с осадком соответствующего вещества).
Осадки, используемые в химическом анализе, относятся к различным классам химических соединений - это соли, основания и кислоты. Чаще всего используют малорастворимые соли. Соли неорганических кислот представляют собой, как правило, сильные электролиты и в растворах практически полностью диссоциируют на ионы.
Основные закономерности для случая, когда осадок образован малорастворимым электролитом, кристаллическая решетка которого построена из ионов, можно представить следующим образом:
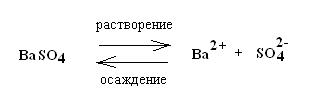
Таким образом, в насыщенном растворе неорганической малорастворимой соли МnАm содержатся в основном только отдельные ионы Мm+ и An-, которые находятся в равновесии с твердой фазой МnAm:
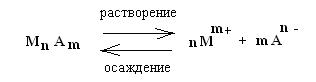
К такой системе применим закон действующих масс:
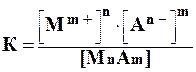
Константа равновесия не зависит от абсолютного количества твердой фазы и при данной температуре является величиной постоянной.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|