
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Клеман-Дезорм әдісімен ауа үшін адиабат
Қ азақ стан республикасының білім жә не ғ ылым министрлігі
Қ. И. Сә тбаев атындағ ы Қ азақ ұ лттық техникалық зерттеу университеті

Ә л-Машани атындағ ы базалық білім беру институты
Жалпы физика кафедрасы
ЗЕРТХАНАЛЫҚ ЖҰ МЫС№8
Клеман-Дезорм ә дісімен ауа ү шін адиабат
кө рсеткішін анық тау

Зертханалық сабақ қ а арналғ ан ә дістемелік нұ сқ ау
Алматы 2021
КЛЕМАН –ДЕЗОРМ Ә ДІСІМЕН АУА Ү ШІН
АДИАБАТ КӨ РСЕТКІШІН АНЫҚ ТАУ
Жұ мыстың мақ саты: Клеман-Дезорм ә дісімен жылу сыйымдылық тарының қ атынасын анық тау кезінде газдағ ы жү ретін изопроцестерді зерттеу жә не ауа ү шін 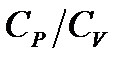 қ атынасын анық тау.
қ атынасын анық тау.
Керекті қ ұ рал-жабдық тар: шыны баллон, су манометрі, компрессор, секундомер.
1. ТЕОРИЯЛЫҚ КІРІСПЕ
1кг заттың температурасын 1К-ге қ ыздыру ү шін қ ажетті жылу мө лшері  меншікті жылу мө лшеріcдеп аталады:
меншікті жылу мө лшеріcдеп аталады:
.
Меншікті жылу сыйымдылық пен қ оса молярлық жылу сыйымдылық ты Сқ олданғ ан ың ғ айлы. 1моль заттың температурасын 1К-ге қ ыздыру ү шін қ ажетті жылу мө лшері молярлық жылу сыйымдылық Сдеп аталады:
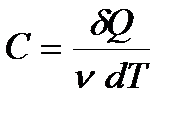 , (1)
, (1)
мұ ндағ ы 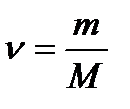 – зат мө лшері, М– молярлық масса.
– зат мө лшері, М– молярлық масса.
Меншікті с жә не молярлық жылу сыйымдылық тардың С арасындағ ы байланыс:
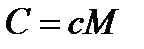 ,
,
орлардың ө лшем бірліктері 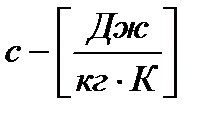 жә не
жә не 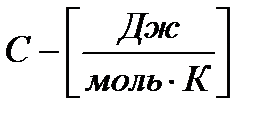 .
.
Егер заттың кө лемі V немесе қ ысымы Р тұ рақ ты болғ ан процесте тұ рақ ты кө лем кезіндегі (  жә не
жә не 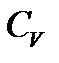 ) жә не тұ рақ ты қ ысым кезіндегі (
) жә не тұ рақ ты қ ысым кезіндегі ( 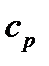 жә не
жә не 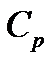 ) меншікті жә не молярлық жылу сыйымдылық тар болып ажыратылады.
) меншікті жә не молярлық жылу сыйымдылық тар болып ажыратылады.
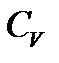 жә не
жә не 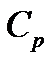 -ларды термодинамиканың бірінші бастамасынан анық таймыз. Жү йеге берілген жылу мө лшері Q жү йенің (газдың ) ішкі энергиясын ө згертуге Δ U жә не газдың сыртқ ы кү штерге қ арсы атқ арғ ан жұ мысына А жұ мсалады:
-ларды термодинамиканың бірінші бастамасынан анық таймыз. Жү йеге берілген жылу мө лшері Q жү йенің (газдың ) ішкі энергиясын ө згертуге Δ U жә не газдың сыртқ ы кү штерге қ арсы атқ арғ ан жұ мысына А жұ мсалады:
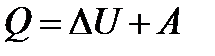
немесе дифференциалдық тү рде былай жазылады:
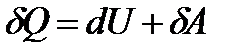 . (2)
. (2)
Жұ мыстың формуласын ескеріп:
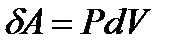 (3)
(3)
жә не жылу мө лшерін 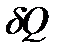 (1) ө рнектен 1 моль газ ү шін термодинамиканың бірінші заң ын мына тү рде жазуғ а болады:
(1) ө рнектен 1 моль газ ү шін термодинамиканың бірінші заң ын мына тү рде жазуғ а болады:
CdT=dUM+pdV . (4)
Изохоралық процесс кезінде ( 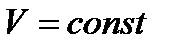 ) газдың атқ аратын жұ мысы нө лге тең (А=0). Ал сырттан газғ а берілген жылу, газдың ішкі энергиясын арттыруғ а (ө згертуге) жұ мсалады. Демек, массасы mгаздың температурасын арттырғ ан кезде оның ішкі энергиясы келесі шамағ а артады:
) газдың атқ аратын жұ мысы нө лге тең (А=0). Ал сырттан газғ а берілген жылу, газдың ішкі энергиясын арттыруғ а (ө згертуге) жұ мсалады. Демек, массасы mгаздың температурасын арттырғ ан кезде оның ішкі энергиясы келесі шамағ а артады:
 . (5)
. (5)
Осыдан, массасы mгаздың температурасын арттырғ ан кезде, оның ішкі энергиясы келесі шамағ а артады:
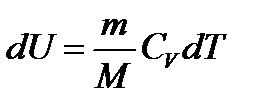 . (6)
. (6)
Егер газ изобаралық ( 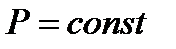 ) қ ызатын болса, онда (4) ө рнекті мына тү рде жазуғ а болады:
) қ ызатын болса, онда (4) ө рнекті мына тү рде жазуғ а болады:
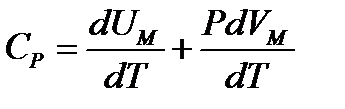 ,
,
мұ ндағ ы 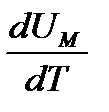 процесс тү ріне тә уелді болмайды (идеал газдың ішкі энергиясы қ ысымғ а да Р кө лемге де V тә уелді емес, тек температурамен анық талады) жә не ол ә рқ ашан
процесс тү ріне тә уелді болмайды (идеал газдың ішкі энергиясы қ ысымғ а да Р кө лемге де V тә уелді емес, тек температурамен анық талады) жә не ол ә рқ ашан 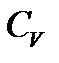 -ғ а тең. Тұ рақ ты қ ысымда (
-ғ а тең. Тұ рақ ты қ ысымда (  ) 1 мольгаз тең деуін
) 1 мольгаз тең деуін 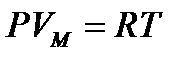 дифференциалдасақ, онда универсал газ тұ рақ тысын аламыз, яғ ни:
дифференциалдасақ, онда универсал газ тұ рақ тысын аламыз, яғ ни:
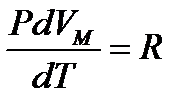 .
.
Нә тижеде: 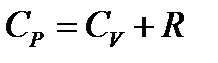 . (7)
. (7)
Бұ л ө рнек (7) Майер тең деуі деп аталады. CPә рқ ашан да 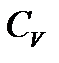 -дан универсал газ тұ рақ тысынаR артық.
-дан универсал газ тұ рақ тысынаR артық.
CPжә не 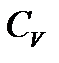 жылу сыйымдылық тарын молекуланың дә режелер саны і арқ ылы ө рнектеуге болады (молекуланың кең істіктегі орнын толық анық тайтын тә уелсіз шамалар саны). Оны молекуланың «еркіндік дә режесі» деп те атайды.
жылу сыйымдылық тарын молекуланың дә режелер саны і арқ ылы ө рнектеуге болады (молекуланың кең істіктегі орнын толық анық тайтын тә уелсіз шамалар саны). Оны молекуланың «еркіндік дә режесі» деп те атайды.
1 моль идеал газдың ішкі энергиясы 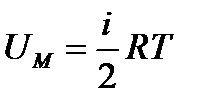 болса, онда:
болса, онда:
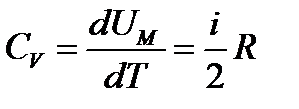 ,
, 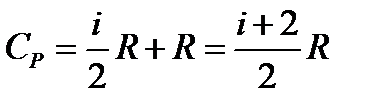 .
.
Термодинамикалық процесстерді қ арастырғ ан кезде ә рбір газ ү шін 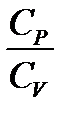 қ атынасын
қ атынасын 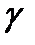 арқ ылы белгілеу маң ызды сипатқ а ие:
арқ ылы белгілеу маң ызды сипатқ а ие:
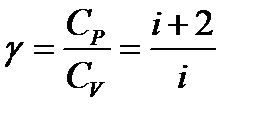 . (8)
. (8)
Молекулалардың еркіндік дә режесі ідеп, молекулалардың кең істікте орынын анық тайтын тә уелсізкоординаттар санын немесе молекулалардың кең істікте қ озғ ала алу мү мкіндіктер санын айтады: біратомды молекула ү шін і=3; екіатомды молекула ү шін і=5; ү шатомды жә не кө патомды молекулалар ү шін і=6.
Адиабаталық процесс тең деуіне кіретін 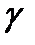 шамасы адиабаттық кө рсеткіш деп аталады. Ол жү йе мен сыртқ ы орта арасында жылу алмасу болмайтындығ ымен (
шамасы адиабаттық кө рсеткіш деп аталады. Ол жү йе мен сыртқ ы орта арасында жылу алмасу болмайтындығ ымен ( 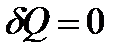 ) сипатталады. Бірінші жуық тауда тез жү ретін процестерді адиабаталық деп есептеуге болады.
) сипатталады. Бірінші жуық тауда тез жү ретін процестерді адиабаталық деп есептеуге болады.
Адиабаталық процесс ү шін термодинамиканың бірінші бастамасынан(2):
 ,
,
яғ ни сыртқ ы кү штердің жасайтын жұ мысы жү йенің ішкі энергиясының ө згеруі есебінен жү реді. Бұ л тең деуден (3) жә не (6) ө рнектерін ескере отырып, мына ө рнекті аламыз:
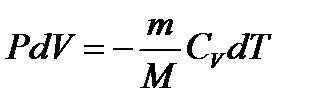 . (9)
. (9)
Бұ дан, газ кө лемінің ө згеруі оның температурасының ө згеруімен қ атар ө згеріп отырады. Минус таң басы адиабаталық ұ лғ аю кезінде (dV> 0) газдың салқ ындауын (dT< 0), ал адиабаталық сығ ылу кезінде (dV< 0) қ ызуын (dT> 0)кө рсетеді.
Идеал газ кү йінің негізгі тең деуін 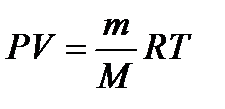 дифференциалдап, мына тең деуді аламыз:
дифференциалдап, мына тең деуді аламыз: 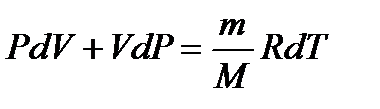 .
.
Алынғ ан тең деуді (9) ө рнекке бө ліп жә не (7) жә не (8) ө рнектерді ескеріп келесі ө рнекті аламыз: 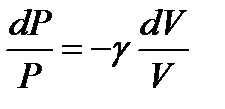 .
.
Бұ л тең деудің екі жағ ын P1-ден P2 дейін жә не V1-ден V2 дейін интегралдап тө мендегі тең деуге келеміз:
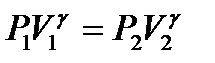 . (10)
. (10)
1 жә не 2 еркін таң дап алынғ ан кү йлер, сондық тан жалпы жағ дайдағ ы адиабаталық процесті мына тү рде жазуғ а болады:
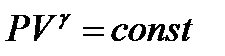 . (11)
. (11)
Бұ л тең деуді (11) Пуассон тең деуі деп атайды. Изотермиялық процесс тең деуі:
PV = const.
(11) тең деудегі адиабаталық кө рсеткішті 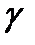 Клеман-Дезорм ә дісімен тә жірибе жү зінде анық тауғ а болады.
Клеман-Дезорм ә дісімен тә жірибе жү зінде анық тауғ а болады.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|