
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таблица «Уравнения ионных реакций»
Таблица «Уравнения ионных реакций»
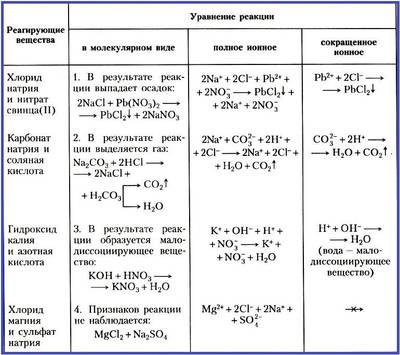
Реакции ионного обмена
Для ионных реакций выражение «в молекулярном виде», как и сама запись, является условным. При анализе приведенных в Таблице уравнений реакций выясняется, что реакции ионного обмена протекают до конца в следующих случаях:
1. если выпадает осадок;
2. если выделяется газ;
3. если образуется малодиссоциирующее вещество, например вода.
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т. е. является обратимой. При составлении уравнений таких реакций, как и при составлении уравнений диссоциации слабых электролитов, ставится знак обратимости.
Чтобы сделать вывод о протекании реакции ионного обмена до конца, надо использовать данные таблицы растворимости солей, оснований и кислот в воде.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
1. Записываем молекулярное уравнение химического процесса.
H2SO4 + KOH = K2SO4 + H2O
2. Балансируем молекулярное уравнение с помощью коэффициентов, согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т. е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
H2SO4 + 2KOH = K2SO4 + 2H2O
3. Определяем, какие вещества в химической реакции диссоциируют, т. е. распадаются на ионы.
Записываем в виде ионов:
растворимые соли;
сильные кислоты (H2SO4, HNO3, HCl и др. );
растворимые в воде основания.
Записываем в виде молекул:
нерастворимые соли;
слабые кислоты,
щелочи, вода;
оксиды;
газы;
простые вещества;
большинство органических соединений.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|