
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ионные уравнения реакций. 1. Образование осадков.
Ионные уравнения реакций
Теоретическая часть:
В водных растворах все электролиты в той или иной степени распадаются на ионы и реакции происходят между ионами.
Сущность реакций в растворах электролитов отражается ионным уравнением. В ионном уравнении учитывается то, что сильный электролит в растворе находится в диссоциированном виде. Формулы слабых электролитов и нерастворимых в воде веществ в ионных уравнениях принято записывать в недиссоциированной на ионы форме. Растворимость электролита в воде нельзя считать критерием его силы. Многие нерастворимые в воде соли являются сильными электролитами, однако концентрация ионов в растворе оказывается низкой вследствие низкой растворимости. Именно поэтому в уравнениях их формулы записывают в недиссоциированной форме.
При составлении ионных уравнений реакций с участием сильных кислот часто для упрощения записывают формулу иона Н+, а не H3O+.
Реакции в растворах электролитов происходят в направлении связывания ионов. Существует несколько форм связывания ионов: образование осадков, выделение газообразных веществ, образование слабых электролитов. Рассмотрим конкретные примеры:
1. Образование осадков.
Уравнение в молекулярном виде:
Ca(NO3)2 + Na2CO3 = СаСO3↓ + 2NaNO3
Полное ионное уравнение:
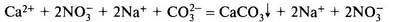
Сокращенное ионное уравнение:
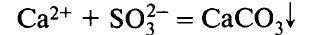
2. Выделение газов (например, СO2, SO2, H2S, NH3):
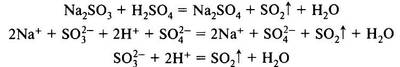
3. Образование слабых электролитов (например, воды, слабых кислот):
а) КОН + НCl = КCl + H2O
К+ + OH– + Н+ + Cl– = К+ + Cl– + H2O
OH– + Н+ = H2O
б) HNO2 – азотистая кислота (слабая):
NaNO2 + НCl = NaCl + HNO2
Na+ + NO2 + Н+ + Cl– = Na+ + Cl– + HNO2
NO2– + Н+ = HNO2
Иногда реакции в растворах электролитов осуществляются с участием нерастворимых веществ или слабых электролитов в направлении более полного связывания ионов. Например, мрамор растворяется в соляной кислоте с образованием углекислого газа:
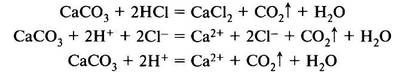
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|