
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Олово и свинец
12. Олово медленно растворяется в разбавленной хлороводородной кислоте с образованием соединений Sn(II):
Sn + 2HClразб ® SnCl2 + H2.
Небольшая скорость реакции объясняется ее небольшой движущей силой: E° = E°(H+/H2) – E°(Sn2+/Sn) = 0 – (–0. 136) = 0. 136 В. Скорость реакции увеличивается при нагревании раствора и в особенности при переходе к концентрированным растворам HCl. Дело еще и в том, что вследствие комплексообразования окислительно-восстановительный потенциал пары Sn(II)/Sn становится более отрицательным.
Sn + 3HClконц ® H[SnCl3] + H2.
С разбавленной серной кислотой олово реагирует подобно тому, как оно реагирует с хлороводородной кислотой, скорость реакции невелика:
Sn + H2SO4разб ® SnSO4 + H2.
В концентрированных растворах серной кислоты S+6 проявляет свойства сильного окислителя, что вызывает образование соединений Sn(IV):
Sn + 4H2SO4конц ® Sn(SO4)2 + 2SO2 + 4H2O.
С разбавленной азотной кислотой олово реагирует с образованием соединений Sn(II):
3Sn + 8HNO3разб ® 3Sn(NO3)2 + 2NO + 4H2O.
С очень разбавленной кислотой возможно образование NH4NO3:
4Sn + 10HNO3оч. разб ® 4Sn(NO3)2 + NH4NO3 + 3H2O.
В то же время взаимодействие с концентрированной азотной кислотой приводит к образованию b-оловянной кислоты:
Sn + 4HNO3конц ® b-SnO2× nH2O¯ + 4NO2 + (2–n)H2O (n < 1).
13. Стандартный электродный потенциал пары Sn2+/Sn (–0, 136 В) существенно положительнее по сравнению с парой Zn2+/Zn (–0, 763 В), следовательно, цинк восстанавливает олово из растворов его солей:
SnCl2 + Zn ® Sn¯ + ZnCl2.
14. Гидроксид олова(II) амфотерен, что можно проиллюстрировать реакциями:
SnCl2 + 2NaOHпо каплям ® Sn(OH)2¯ + 2NaCl.
Sn(OH)2¯ + NaOH ® Na[Sn(OH)3] (растворение осадка)
Sn(OH)2¯ + 2HCl ® SnCl2 + 2H2O (растворение осадка).
Обратите внимание: координационное число Sn(II) равно трем!
15. Сульфиды олова получают осаждением сульфидом аммония в кислой среде:
SnCl2 + (NH4)2S 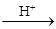 SnS¯ + 2NH4Cl
SnS¯ + 2NH4Cl
SnCl4 + 2(NH4)2S 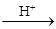 SnS2¯ + 4NH4Cl.
SnS2¯ + 4NH4Cl.
SnS2 проявляет свойства кислотного сульфида и образует тиосоли:
SnS2¯ + (NH4)2S ® (NH4)2SnS3 (растворение осадка).
SnS выраженных кислотных свойств не проявляет, для его растворения необходимо перевести Sn(II) в Sn(IV), т. е. подействовать дисульфидом аммония:
SnS¯ + (NH4)2S2 ® (NH4)2SnS3 (растворение осадка).
16. Соединения Sn(II) проявляют свойства восстановителей и восстанавливают ртуть и растворов ее солей. С сулемой (HgCl2) реакция протекает в две стадии:
SnCl2 + 2HgCl2 ® Hg2Cl2¯ (каломель) + SnCl4
SnCl2 + Hg2Cl2¯ белый ® 2Hg¯ черный, металлический + SnCl4.
17. В реакциях с перманганатом калия и дихроматом калия соединения Sn(II) также проявляют восстановительные свойства:
10SnCl2 + 4KMnO4 + 16H2SO4 ® 5SnCl4 + 5Sn(SO4)2 + 4MnSO4 + 2K2SO4 + 16H2O.
6SnCl2 + 2K2Cr2O7 + 14H2SO4 ® 3SnCl4 + 3Sn(SO4)2 + 2Cr2(SO4)3 + 2K2SO4 + 14H2O.
18. При добавлении раствора аммиака к соединениям Sn(IV) выпадает осадок a-оловянной кислоты SnO2× nH2O (n > 1). В структуре полимерной a-оловянной кислоты преобладают олированные фрагменты (соединение двух атомов олова через мостиковую OH-группу). По этой причине a-оловянная кислота достаточно реакционноспособна и взаимодействует с растворами кислот и щелочей:
SnCl4 + 4NH3× H2O ® a-SnO2× nH2O¯ + 4NH4Cl + (2–n)H2O.
a-SnO2× nH2O¯ + 2NaOH + (2–n)H2O ® Na2[Sn(OH)6] (растворение осадка)
a-SnO2× nH2O¯ + 6HCl ® H2[SnCl6] + (2+n)H2O (растворение осадка).
С течением времени a-оловянная кислота «стареет» и ее реакционная способность снижается.
19. При взаимодействии олова с концентрированной азотной кислотой при нагревании образуется осадок b-оловянной кислоты SnO2× nH2O (n < 1). В структуре b-оловянной кислоты преобладают оксолированные фрагменты (соединение двух атомов олова через мостиковый атом кислорода). b-оловянная кислота обладает низкой реакционной способностью и не реагирует с растворами кислот и щелочей:
Sn + 4HNO3, ~50% 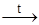 b-SnO2× nH2O¯ + 4NO2 + (2–n)H2O
b-SnO2× nH2O¯ + 4NO2 + (2–n)H2O
 b-SnO2× nH2O¯ + NaOHраствор ®
b-SnO2× nH2O¯ + NaOHраствор ®
 b-SnO2× nH2O¯ + HClраствор ®.
b-SnO2× nH2O¯ + HClраствор ®.
20. Свинец практически не взаимодействует с холодными разбавленными растворами хлороводородной кислоты вследствие образования на его поверхности слоя малорастворимого PbCl2, защищающего металл от растворения:
 Pb + HCl ®
Pb + HCl ®
Растворимость галогенидов свинца увеличивается при нагревании раствора, поэтому с горячим раствором HCl реакция протекает:
Pb + 2HCl ® PbCl2 + H2.
Реакция также возможна в концентрированных растворах HCl по причине комплексообразования:
Pb + 4HClконц ® H2[PbCl4] + H2.
C разбавленной серной кислотой свинец не реагирует по причине образования на его поверхности нерастворимого PbSO4:
 Pb + H2SO4 ®
Pb + H2SO4 ®
C концентрированными растворами серной кислоты реакция протекает по причине образования сульфатного комплекса, который ранее считали гидросульфатом свинца(II) Pb(HSO4)2:
Pb + 3H2SO4конц  H2[Pb(SO4)2] + SO2 + 2H2O.
H2[Pb(SO4)2] + SO2 + 2H2O.
С разбавленной азотной кислотой свинец реагирует по уравнению:
3Pb + 8HNO3разб ® 3Pb(NO3)2 + 2NO + 4H2O.
Концентрированная азотная кислота пассивирует свинец, и реакция не идет. Однако она становится возможной при сильном нагревании раствора:
Pb + 4HNO3конц 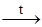 Pb(NO3)2 + 2NO2 + 2H2O.
Pb(NO3)2 + 2NO2 + 2H2O.
21. Особенностью химии Pb(II) является то, что он образует мало растворимых солей. Растворимы нитрат, ацетат, борфторид и некоторые другие соли свинца. Во многих случаях выпадают малорастворимые осадки:
Pb(CH3COO)2 + H2SO4разб ® PbSO4¯ (белый) + 2CH3COONa
3Pb(CH3COO)2 + 3Na2CO3 + H2O ® 2PbCO3× Pb(OH)2¯ (белый) + CO2 + 6CH3COONa
Pb(CH3COO)2 + Na2S ® PbS¯ (черный) + 2CH3COONa
Pb(CH3COO)2 + 2KI ® PbI2¯ (желтый) + 2CH3COONa.
При действии раствора пероксида водорода на сульфид свинца происходит его окисление до сульфата:
PbS¯ (черный) + 4H2O2 ® PbSO4¯ (белый) + 4H2O.
Йодид свинца перекристаллизуется из горячего раствора, в результате выпадают красивые золотистые иглы PbI2.
22. Цинк вытесняет свинец из растворов его солей:
Zn + Pb(CH3COO)2 ® Pb¯ + Zn(CH3COO)2.
23. Гидроксид свинца(II) проявляет амфотерные свойства, которые выражены несколько слабее по сравнению с оловом(II):
Pb(CH3COO)2 + 2NaOHпо каплям ® Pb(OH)2¯ + 2CH3COONa
Pb(OH)2¯ + 2NaOHконц ® Na2[Pb(OH)4] (растворение осадка)
Pb(OH)2¯ + 2HNO3 ® Pb(NO3)2 + 2H2O (растворение осадка).
24. Оксид свинца(II) растворяется в растворе азотной кислоты
PbO + 2HNO3 ® Pb(NO3)2 + H2O.
Сурик (Pb3O4) может быть представлен как 2PbO× PbO2. Действие азотной кислоты приводит к разделению степеней окисления +2 и +4:
Pb3O4 + 4HNO3 ® 2Pb(NO3)2 + PbO2¯ + 2H2O.
Ионы Pb2+ в фильтрате обнаруживаются по реакции с KI:
Pb(NO3)2 + 2KI ® PbI2¯ (желтый) + 2KNO3.
25. При взаимодействии PbO с горячей хлороводородной кислотой наблюдается образование растворимого в горячей воде хлорида свинца(II):
PbO + 2HCl 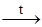 PbCl2 + H2O.
PbCl2 + H2O.
С PbO2 и Pb3O4 протекают окислительно-восстановительные реакции, сопровождающиеся выделением хлора:
PbO2 + 4HCl 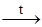 PbCl2 + Cl2 + 2H2O
PbCl2 + Cl2 + 2H2O
Pb3O4 + 8HCl 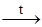 3PbCl2 + Cl2 + 4H2O.
3PbCl2 + Cl2 + 4H2O.
26. Оксид свинца(IV) является сильным окислителем и способен окислить ионы Mn2+ до перманганат-ионов (обнаружение ионов марганца по В. Круму):
5PbO2 + 2MnSO4 + 6HNO3 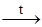 2PbSO4 + 3Pb(NO3)2 + 2HMnO4 + 2H2O.
2PbSO4 + 3Pb(NO3)2 + 2HMnO4 + 2H2O.
В результате протекания реакции возникает фиолетовая окраска раствора. В реакции надо брать избыток азотной кислоты и прибавлять к окислительной смеси лишь несколько капель раствора, содержащего ионы марганца, в противном случае из-за протекания реакции контрдиспропорционирования соединений марганца образуется осадок MnO2.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|