
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Углерод и кремний
1. Обугливание сахара в процессе его термолиза:
C12H22O11 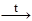 12C(уголь) + 11 H2O
12C(уголь) + 11 H2O
В результате образуется уголь, характеризующийся высокой удельной площадью поверхности (до 1000 м2/г).
2. Уголь окисляется концентрированной серной кислотой:
C + 2H2SO4(конц) 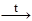 CO2 + 2SO2 + 2H2O.
CO2 + 2SO2 + 2H2O.
3. Активированный уголь обладает высокой удельной площадью поверхности (до 800–1000 м2/г). В результате становится возможной адсорбция различных частиц на поверхности активированного угля в результате сложных физико-химических взаимодействий между молекулами вещества, находящимися в растворе, и поверхностью углеродного адсорбента. Раствор используемого в тесте красителя обесцвечивается.
4. При взаимодействии CO2 с водой происходят следующие взаимодействия:
CO2 + H2O ⇄ CO2× H2O ⇄ H2CO3 ⇄ H+ + HCO3–.
В результате в растворе создается слабокислая среда, что может быть зафиксировано при помощи лакмуса.
В растворе щелочи происходит процесс ее карбонизации:
2NaOH + CO2 ® Na2CO3 + H2O
Na2CO3 + CO2 + H2O ® 2NaHCO3.
5. А) Ионы Ca2+, Sr2+, Ba2+ не гидролизуются, поэтому при взаимодействии растворов, содержащих эти ионы, с растворами карбонатов происходит образование осадка КАРБОНАТОВ щелочноземельных элементов:
CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl
SrCl2 + Na2CO3 ® SrCO3¯ + 2NaCl
BaCl2 + Na2CO3 ® BaCO3¯ + 2NaCl
или обобщенно
M2+ + CO32– ® MCO3¯
Б) Ионы Mg2+, Co2+, Ni2+, Cu2+, Zn2+, Pb2+ подвержены гидролизу, поэтому при взаимодействии растворов, содержащих эти ионы с растворами карбонатов происходит выпадения осадков переменного состава xM(OH)2× yMCO3× zH2O, которые условно могут быть представлены как ОСНОВЫЕ КАРБОНАТЫ:
4MgCl2 + 4Na2CO3 + 4H2O ® 3MgCO3× Mg(OH)2× 3H2O¯ + CO2 + 8NaCl:
2CoCl2 + 2Na2CO3 + H2O ® CoCO3× Co(OH)2¯ + CO2 + 4NaCl
2NiCl2 + 2Na2CO3 + H2O ® NiCO3× Ni(OH)2¯ + CO2 + 4NaCl
2CuCl2 + 2Na2CO3 + H2O ® CuCO3× Cu(OH)2¯ + CO2 + 4NaCl
2CoCl2 + 2Na2CO3 + H2O ® CoCO3× Co(OH)2¯ + CO2 + 4NaCl
4ZnCl2 + 4Na2CO3 + H2O ® 3ZnCO3× Zn(OH)2¯ + CO2 + 8NaCl
3Pb(CH3COO)2 + 3Na2CO3 + H2O ® 2PbCO3× Pb(OH)2¯ + CO2 + 6CH3COONa
В) Сильногидролизующиеся ионы Al3+, Cr3+, Fe3+ при взаимодействии с растворами карбонатов образуют осадки ГИДРОКСИДОВ:
Al2(SO4)3 + 3Na2CO3 + 3H2O ® 2Al(OH)3¯ + 3CO2 + 3Na2SO4
Cr2(SO4)3 + 3Na2CO3 + 3H2O ® 2Cr(OH)3¯ + 3CO2 + 3Na2SO4
Fe2(SO4)3 + 3Na2CO3 + 3H2O ® 2Fe(OH)3¯ + 3CO2 + 3Na2SO4
6. Разложение основного карбоната меди может быть описано уравнением:
Cu2(OH)2CO3 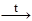 2CuO + CO2 + H2O.
2CuO + CO2 + H2O.
Выделение CO2 может быть обнаружено по помутнению избытка известковой воды:
Ca(OH)2изб + CO2 ® CaCO3¯ + H2O.
Термическое разложение гидрокарбоната натрия и карбоната аммония описывается уравнениями:
2NaHCO3 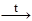 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
(NH4)2CO3 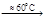 2NH3 + CO2 + H2O.
2NH3 + CO2 + H2O.
7. Магнийтермическое получение кремния описывается уравнением:
2Mg + SiO2 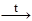 Si + 2MgO.
Si + 2MgO.
Образовавшийся кремний частично реагирует с магнием; в избытке Mg основным продуктом взаимодействия является Mg2Si:
2Mg + Si 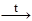 Mg2Si.
Mg2Si.
Обработка образовавшейся смеси веществ 25%-ной HCl приводит к растворению непрореагировавшего магния и силицида магния:
Mg + 2HCl ® MgCl2 + H2
Mg2Si + 4HCl ® 2MgCl2 + SiH4.
Образующиеся в последней реакции силаны самопроизвольно воспламеняются на воздухе:
SiH4 + 2O2 ® SiO2 + 2H2O.
Образовавшийся в тесте аморфный кремний реагирует с водным раствором щелочи, при этом выделяется водород, а в растворе образуются силикаты, что упрощенно может быть представлено уравнением:
Si + 2NaOH + H2O ® Na2SiO3 + 2H2.
8. При добавлении к раствору силиката натрия хлороводородной кислоты образуется золь кремниевой кислоты:
Na2SiO3 + 2HCl + (n–1)H2O ® SiO2× nH2O¯ + 2NaCl.
Образование золя кремниевых кислот протекает в результате сложных процессов поликонденсации кремниевых кислот. Первая стадия поликонденсации может быть представлена уравнением:
2H4SiO4 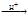 (HO)3SiOSi(OH)3 + H2O.
(HO)3SiOSi(OH)3 + H2O.
В дальнейшем образуются цепочечные, слоистые и смешанные структуры SiO2× nH2O.
При нагревании золь кремниевой кислоты переходит в гель.
9. Кремниевые кислоты – очень слабые и достаточно небольшого подкисления раствора, чтобы вызвать их образование:
Na2SiO3 + 2NH4Cl + (n+1)H2O ® SiO2× nH2O¯ + 2NH3× H2O + 2NaCl
Na2SiO3 + 2CO2 + (n+1)H2O ® SiO2× nH2O¯ + 2 NaHCO3.
10. Выщелачивание стекла может быть условно описано уравнением
Na2O× CaO× 6SiO2 + (3+6n)H2O ® 2NaOH + Ca(OH)2 + 6 SiO2× nH2O¯.
При протекании этого процесса происходит 1) гидратация и переход в раствор щелочей, присутствующих в стекле и 2) проникновение воды внутрь стекла, т. е. его гидратация.
Щелочную среду образующегося раствора можно определить по появлению малиновой окраски фенолфталеина.
11. Тетрахлорид кремния, в отличие от тетрахлорида углерода, «дымит» на воздухе вследствие взаимодействия с парами воды:
SiCl4 + (2+n)H2O ® SiO2× nH2O¯ + 4HCl.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|