
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СН2ОН—СНОН—СН2ОН.
Физические свойства. Глицерин — сиропообразная бесцветная жидкость сладкого вкуса; температура замерзания 17°, кипения 290°С; плотность его 1, 26. Глицерин неограниченно смешивается с водой и спиртом, но нерастворим в эфире и хлороформе; сам способен растворять многие органические (сахар), а также и неорганические соединения (многие соли, например гипс). При смешивании с водой происходит уменьшение объёма (контракция), достигающее наибольшего значения для смеси, содержащей 57% глицерина; при этом выделяется тепло. Чистый глицерин гигроскопичен, он поглощает до 40% воды (по весу). Водные растворы глицерина замерзают при низких температурах, например, смесь, содержащая 66, 7% глицерина, замерзает при минус 46, 5°С.
Химические свойства глицерина определяются наличием в его молекуле трех гидроксильных групп, благодаря чему он может давать три ряда производных, (причем моно- и ди-производные могут существовать в двух структурно-изомерных формах).
Монопроизводные глицерина типа СН2Х—СНОН—СН2ОН
дипроизводные СН2Х—СНХ—СН2ОН.
и трипроизводные СН2Х—СНХ—СН2Х
1). Для глицерина характерны реакции нуклеофильного замещения спиртовых функциональных групп. Например, при взаимодействии глицерина с хлороводородом:
СН2 ОН -СН ОН -СН2 ОН + 3H Cl => СН2Cl-СНCl-СН2Cl + 3H-ОН
т. е. может образоваться 1, 2, 3-трихлорпропан (один из вариантов).
2). При действии на глицерин не только активных металлов (натрий), но даже оксидов и гидроксидов тяжелых металлов могут получаться производные глицерина — глицераты металлов, например меди. Это свидетельствует о том, что кислотные свойства у глицерина выражены значительно сильнее, чем у одноатомных спиртов.
СН2ОН—СНОН—СН2ОН + Na => СН2ОН—СНОН—СН2О-Na + H2
Или СН2ОН—СНОН—СН2ОН + Cu(OH)2↓ => образуется растворимое комплексное соединение синего цвета
9. Нахождение в природе и получение. Глицерин был открыт в 1779 г. Шееле. В свободном состоянии глицерин в небольших количествах содержится в крови животных.
Природные жиры и масла состоят из сложных эфиров глицерина и карбоновых кислот. Под действием различных катализаторов жиры в организме расщепляются на глицерин и кислоты (это реакция гидролиза жиров).
В настоящее время в промышленном производстве синтетического глицерина используют непищевое сырье (природные предельные углеводороды).
Применение: Глицерин находит широкое применение в медицине и производстве фармацевтических препаратов. Его используют для растворения веществ. Глицерин является отличным растворителем йода, брома, фенола и т. д. Используя глицерин вместо воды, можно приготовить высококонцентрированные медицинские растворы. Глицерин обладает антисептическими свойствами, поэтому его применяют для предотвращения заражения ран. Антисептические и консервирующие свойства глицерина связаны с его гигроскопичностью, благодаря которой происходит дегидратация бактерий. Безводный глицерин гигроскопичен, может вызвать ожег кожи, т. к. отнимает от нее воду, а водный раствор глицерина используют для смягчения кожи, предохранения от высыхания мазей, паст и кремов. В медицине используют также тринитроглицерин, он расширяет кровеносные сосуды.
При получении пластмасс и смол глицерин является ценным сырьем. Эфиры глицерина широко применяют в производстве прозрачных упаковочных материалов. Например, целлофан обладает отличной гибкостью и не теряет своих свойств ни в жаре, ни в холоде. При получении водонепроницаемых упаковочных материалов применяют композицию, состоящую из глицерина, протеиновых веществ, льняного масла и пигмента. С целью придания бумажным упаковочным материалам огнестойкости их пропитывают под давлением водным раствором глицерина.
В пищевой промышленности глицерин используют для приготовления экстрактов чая, кофе, имбиря и других растительных веществ. Глицерин широко применяют при производстве безалкогольных напитков. Крупные предприятия производящие алкогольные напитки расходуют более 450 т глицерина высшего сорта в год для приготовления экстракта, который в разбавленном состоянии придает напиткам " мягкость ". Глицерин используют при получении горчицы, желе и уксуса. Применяют глицерин для получения пищевых поверхностно-активных веществ (ПАВ), используемых в качестве добавок, способствующих повышению качества готовой продукции. При выработке хлебобулочных изделий ПАВ способствуют равномерному распределению жиров в тесте, предотвращают слипание клейковины и крахмала при выпечке. В связи с этим увеличивается объем хлеба и замедляется его очерствение. При производстве кондитерских изделий ПАВ уменьшают прилипание карамели, не допускают " поседения" шоколада в процессе хранения. При выработке мороженого ПАВ позволяют получить более тонкую структуру, хорошую твердость и постоянную форму продукта. В макаронных изделиях ПАВ уменьшают клейкость крахмала. ПАВ в больших количествах применяют при производстве маргарина. Они играют роль высокотемпературных стабилизаторов и эмульгаторов
Сельское хозяйство Глицерин используют при обработке семян и сеянцев, разбавленные растворы глицерина помогают прорастанию семян и укоренению саженцев.
Электротехника и радиотехника. В радиотехнике глицерин широко используют в производстве электролитических конденсаторов. Глицерин применяют при обработке алюминия и его сплавов. Глицерин используют при производстве алкидных смол, которые применяют как изоляционный материал.
В текстильной промышленности глицерин применяют в прядении, ткачестве, печатании, крашении и шлихтовании. Глицерин придает тканям эластичность и мягкость. Его используют для получения анилиновых красок, растворителей для красок, а также в качестве антисептической и гигроскопической добавки к краскам для печатания. Глицерин широко используют при производстве синтетического шелка и шерсти. В бумажной промышленности глицерин применяют при выпуске кальки, пергамента, папиросной бумаги, бумажных салфеток и жиронепроницаемой бумаги. В кожевенной промышленности глицерин добавляют к водным растворам хлорида бария, который используют в качестве препарата для консервирования кож. Глицерин является одним из компонентов восковых эмульсий для дубления кож. В процессе жировки кож используют глицериновые растворы
Лакокрасочная промышленность. Глицерин - ценный компонент полировочных составов, особенно лаков, применяемых для окончательной отделки. В процессе этерификации канифоли с глицерином образуется продукт, используемый для производства различных лаков. Многоосновные кислоты при конденсации с глицерином образовывают смолообразные продукты, называемые глифталями. Глицерин 98 %-ный применяют для производства электроизоляционных лаков.
Производство моющих и косметических средств. Большое количество сортов туалетного мыла и различные кремы содержат глицерин, который усиливает моющую способность, придает белизну коже и смягчает ее. Глицериновое мыло способствует удалению красящих веществ кожи, загоревшей на солнце. Многие прозрачные сорта туалетного мыла имеют массовую долю глицерина 8-15 %.
Военное дело. Глицерин используют для получения нитроглицерина, из которого производят динамит, бездымный порох и другие взрывчатые вещества, применяемые в мирных целях и военном деле. Кроме того, динамитный глицерин используют в качестве незамерзающих растворов в различных двигателях, тормозной и нагревающей жидкости, для охлаждения стволов орудий.
10.
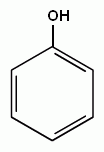
ФЕНОЛЫ – класс органических соединений, которые содержат одну или несколько групп –ОН, соединенного непосредственно с атомами углерода бензольного кольца.
Классификация фенолов. 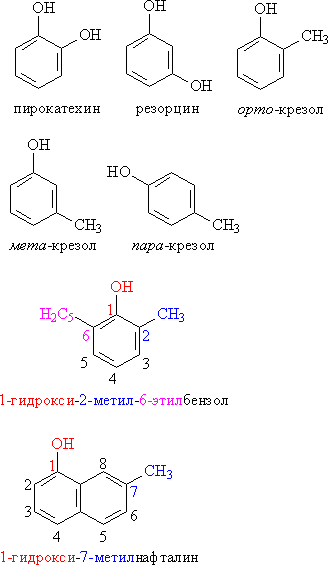
Рис. 1. ОДНО-, ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
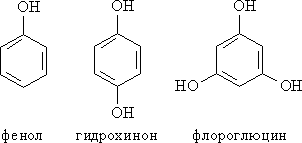
Рис. 2. МОНО- И ПОЛИЯДЕРНЫЕ ФЕНОЛЫ

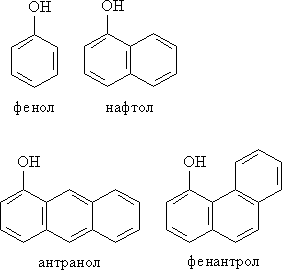
Номенклатура. Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов, указывают положение заместителей.
11. Физические свойства фенола. Бесцветное кристаллическое вещество, температура плавления 41 оС, обладает характерным запахом. Многоатомные фенолы запаха не имеют. При хранении кристаллы становятся розоватыми, потом фиолетовыми. В холодной воде фенол растворяется очень плохо ( 8 г в 100 мл при 15Со), но при нагревании граница раздела между жидким фенолом и водой постепенно исчезает, раствор становиться прозрачным. Фенол вызывает денатурацию белка, поэтому обладает антисептическими свойствами. При попадании на кожу может вызвать ожоги. На коже появляются белые пятна, которые позже темнеют. При попадании в организм вызывает тяжелые отравления.
 Строение молекулы фенола. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа (С6Н5-) оттягивает на себя не поделенную электронную пару от атома кислорода в ОН-группе. В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком δ +), полярность связи О–Н возрастает, и связь разрывается легче, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через δ –), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
Строение молекулы фенола. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа (С6Н5-) оттягивает на себя не поделенную электронную пару от атома кислорода в ОН-группе. В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком δ +), полярность связи О–Н возрастает, и связь разрывается легче, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через δ –), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
12. Химические свойства. Для фенолов возможны два типа превращений: замещение водорода в ОН-группе и замещение водорода в бензольном ядре.
1. Реакции замещения атома водорода в ОН-группе. При действии на фенолы щелочных металлов или щелочей образуются феноляты. Кислотность фенолов значительно выше, чем у спиртов. Повышенная кислотность фенолов проявляется в том, что они взаимодействуют с водными растворами щелочей (реакция нейтрализации), образуя соли феноксиды (или феноляты). Причина этого – смещение электронной плотности гидроксогруппы в сторону бензольного кольца (фенил – акцептор электронной плотности) и поляризация связи между кислородом и водородом в гидроксогруппе.
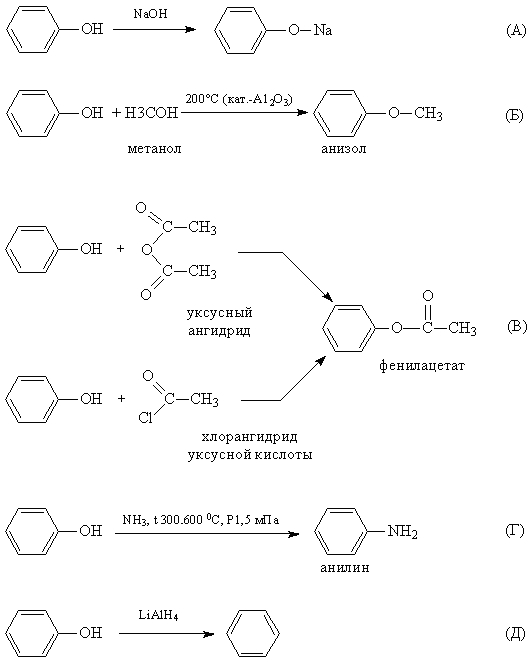
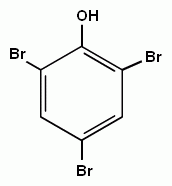
Феноляты могут существовать в водных щелочных растворах (в отличии от алкоголятов). Но при пропускании углекислого газа через раствор фенолята выделяется свободный фенол. Значит карболовая кислота, так часто называют фенол, более слабая, чем угольная кислота. Но если в бензольное кольцо ввести электроотрицательный заместитель (например, нитрогруппу), то полярность связи О-Н увеличивается и тринитрофенол по кислотности приближается к сильным минеральным кислотам, поэтому его называют пикриновой кислотой.
2. Пара электронов атома кислорода, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи (нуклеофильное замещение), характерные для спиртов, для фенолов не типичны, но возможны. При взаимодействии с аммиаком (повышенная температура и давление) происходит замена ОН-группы на NH2, образуется анилин. Возможно и нуклеофильное замещение на галогены, но для реакции замещения с галогеноводородами лучше вместо фенола брать фенолят натрия.
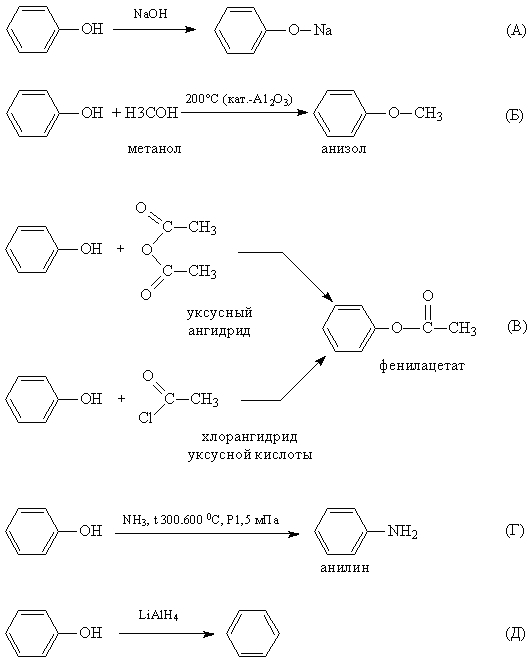
3. Реакции замещения атомов водорода в бензольном кольце, характерные для бензола, будут протекать и для фенолов. При галогенировании, нитровании и некоторых других реакциях атакуются центры с повышенной
| + Cl2→ |
| + HCl |
| или |
| + HBr |
| +Br2→ |
электронной плотностью, т. е. замещение проходят преимущественно в орто- и пара- положениях и, кроме того, значительно легче происходит замещение двух и трех атомов водорода в бензольном кольце.
4. С раствором хлорида железа (Ш) фенолы дают цветное окрашивание. Например, раствор фенол окрашивает раствор в сине-фиолетовый цвет. Эту реакцию часто используют как качественную, для определения присутствия фенола.
13. Способы получения фенолов. Фенолы выделяют перегонкой из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха.
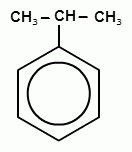
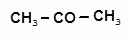 + О2 → +
+ О2 → +
Применение фенолов. Раствор фенола (карболовая кислота) - первый антисептик, введенный в хирургию. Двухатомные фенолы – пирокатехин, резорцин (см. начало лекции), а также гидрохинон (пара-дигидроксибензол) применяют как антисептики в медицине и ветеринарии (антибактериальные обеззараживающие вещества). В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин. Пирокатехин – структурный элемент многих БАВ, например, катехоламинов, его метиловый эфир (гваякол) – применяют для лечения верхних дыхательных путей. Кроме того, производные фенола используют как красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – фенолоальдегидных смол, полиамидов, полиэпоксидов. Пирокатехин и резорцин вводят в состав дубителей для кожи и меха, используют как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии. Конденсированные фенолы входят в состав нефти и каменного угля. Используют для получения многих лекарственных соединений. Нафтол – важная составная часть «молодой нефти» нафталана, которая используется для лечения заболеваний кожи, опорно-двигательного аппарата и т. д. Структура фенантрола лежит в основе строения холестерина и других стероидов в организме человека.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|