
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
5. Взаимодействие щелочных металлов с кислотами.
5. Взаимодействие щелочных металлов с кислотами.
2Na +2HСl = 2NaСl + H2
2K + H2SO4(p) = K2SO4 + H2
6. Взаимодействие с водой:
2Na + 2H2O = 2NaOH + H2
7. с водородом:
2Li + H2 = 2LiH (гидрид лития)
7. Качественная реакция на ионы щелочных металлов - окраска пламени
Li+ - ярко-малиновая;
Na+ - желтая;
K+ - сине-фиолетовая.
Важнейшие соединения щелочных металлов.
1. Оксиды щелочных металлов– основные оксиды.
1. с водой образуют щелочи.
Na2O + H2O = 2NaOH
2. с кислотными оксидами образуют соли.
Na2O + CO2 = Na2CO3
3. с кислотами образуют соль и воду.
Na2O + 2HCl = 2NaCl + H2O
2. Гидроксиды щелочных металлов - щелочи
Гидроксиды щелочных металлов устойчивы к нагреванию, за исключением гидроксида лития.
1. с кислотами (реакция нейтрализации) образуется соль и вода.
NaOH + HCl = NaCl + H2O
2. с кислотными оксидами могут образоваться средниеи кислые соли.
2NaOH + CO2 = Na2CO3 + H2O
Карбонат
натрия
NaOH + CO2 = NaHCO3
Гидрокарбонат
Натрия
3. с солями
2LiOH + CuSO4 = Li2SO4 + Cu(OH)2↓
Щелочь + соль = соль + нерастворимое основание
4. с амфотерными основаниями
NaOH + Zn(OH)2= Na2[Zn(OH)4] (в растворе – мокрый путь)
Тетрагидроксоцинкат
натрия
2 NaOH + Zn(OH)2 → Na2ZnO2 + 2 H2O (сухой путь)
Цинкат
натрия
Получение щелочей KOH и NaOH в промышленности электролизом растворов хлоридов.
2NaCl + 2H2O = H2 + 2NaOH + Cl2
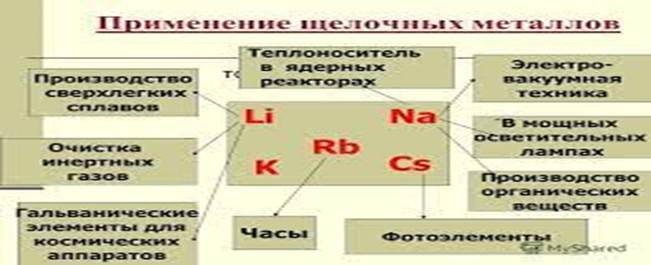

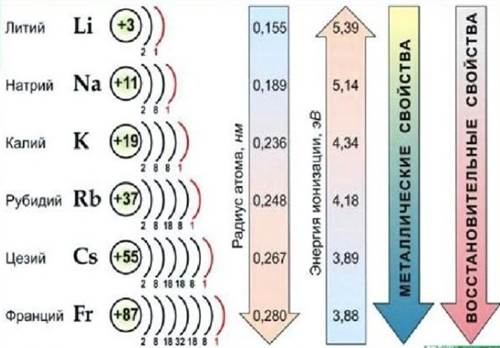
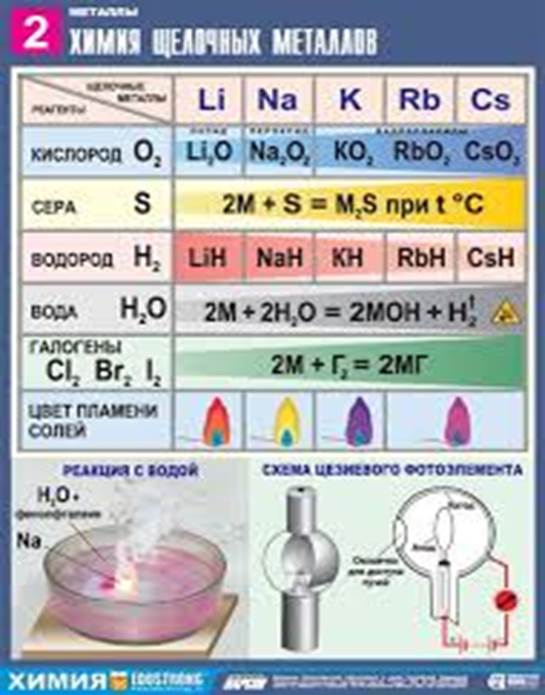
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|