
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
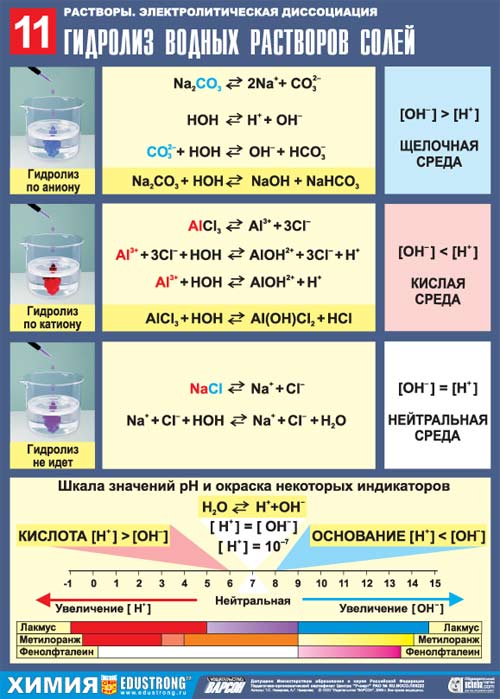
Гидролиз - процесс обратимый.. Алгоритм составления уравнений гидролиза солей
⇐ ПредыдущаяСтр 2 из 2
Гидролиз - процесс обратимый.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
Алгоритм составления уравнений гидролиза солей
| Ход рассуждений | Пример |
| 1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль. Помните! Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой. | Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3) |
| 2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли: | 2Na+ + CO32- + H+OH- ↔ Это гидролиз по аниону От слабого электролита в соли присутствует анион CO32-, он будет связываться молекулами воды в слабый электролит – происходит гидролиз по аниону. |
| 3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды | 2Na+ + CO32- + H+OH- ↔ (HCO3)- + 2Na++ OH- В продуктах реакции присутствуют ионы ОН-, следовательно, среда щелочная pH> 7 |
| 4. Записываем молекулярное гидролиза | Na2CO3 + HOH ↔ NaHCO3 + NaOH |
| Кислота | Основания |
| Слабые - CH3COOH, H2CO3, H2S, HClO, HClO2 Средней силы - H3PO4 Сильные - НСl, HBr, HI, НNО3, НСlO4, Н2SO4 | Слабые – все нерастворимые в воде основания и NH4OH Сильные – щёлочи (искл. NH4OH) |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|