
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
БЕЛКИ. Химические свойства
БЕЛКИ
Белки – природные полимеры, состоящие из аминокислот, связанных между собой пептидными связями. Играют фундаментальную роль в структуре и жизнедеятельности живых организмов.
По химическому составу белки делят на две основные группы. Протеины (простые белки) – белки, при гидролизе, которых образуются только аминокислоты. Протеиды (сложные белки) – белки, которые при гидролизе помимо аминокислот дают и другие соединения, например углеводы, липиды, нуклеиновые кислоты, фосфорные кислоты.
В состав белков входит более 25 различных аминокислот. Белки различаются по качественному и количественному содержанию аминокислот, по взаиморасположению аминокислотных остатков.
Белковая молекула имеет сложное строение. Может состоять из одной или нескольких цепей, содержащих от 50 до нескольких сотен (иногда - более тысячи) аминокислотных остатков. Молекулярная масса белков составляет от нескольких тысяч до нескольких миллионов.
Белки имеют сложную структуру:
1. Первичная структура - последовательность аминокислот в полипептидной цепи.
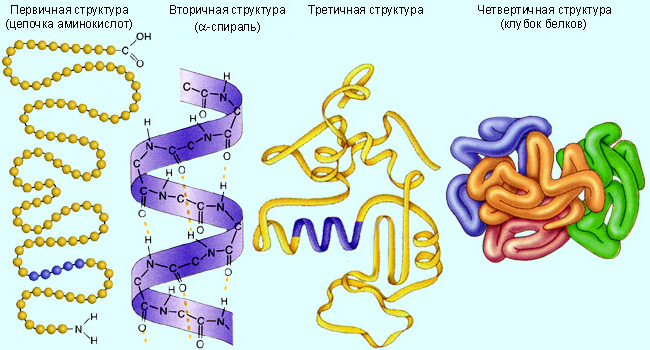
Рисунок 1 Уровни организации белковой молекулы
Вторичная структура − это пространственное расположение полипептидной цепочки в виде α -спирали. Она стабилизирована водородными связями, амидными (-N-H) и карбонидными (-C=O) группами.
Под третичной структурой понимают пространственное расположение α -спирали в виде глобулы, стабилизированной всеми видами связей между аминокислотными остатками. Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами. Между собой домены обычно бывают связаны тонкими перемычками дисульфидными мостиками − S− S−.
Большинство белков имеют третичную структуру, но некоторые имеют
Четвертичную структуру - это сложный комплекс объединенных третичных структур. Примером может служить молекула гемоглобина (четыре субъединицы), вирус табачной мозаики (2130 субъединиц).
Физические свойства белков определяются тем, к какому классу они относятся.
Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это – основной строительный материал тканей: сухожилий. Мускульных и покровных тканей. Такие белки в воде не растворимы.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд жизненных функций, требующих их подвижности. Поэтому они растворимы в воде либо в растворах кислот или оснований и имеют коллоидную структуру.
Химические свойства
1 Денатурация - необратимое осаждение (свертывание) белков при нагревании, под действием сильных кислот или оснований, солей тяжелых металлов или других реагентов. При денатурации происходит изменение во вторичной и третичной структурах белка.
2. Гидролиз – основа процесса пищеварения. В желудке под действием ферментов и соляной кислоты происходит разрушение первичной структуры белка. В результате гидролиза белковые молекулы распадаются на аминокислоты.
3. Качественные (цветные) реакции:
А) Биуретовая реакция:
Белок + NaOH + CuSO4 → фиолетовое окрашивание
Б) Ксантопротеиновая реакция:
Белок + HNO3 (концент. ) → желтое окрашивание
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|