
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Примеры решения задач. Решение. Решение
Примеры решения задач
Задача 1. Газ массой М (кг) расширяется по изобаре при абсолютном давлении Р (МПа) так, что его температура повышается от t1 (оС) до t2 (оС). Определить конечный объём газа V2 (м3), совершённую работу L (кДж), подведённую теплоту Q (кДж) и изменение внутренней энергии Δ U (кДж).
Дано: М = 0, 55 кг;
Р =0, 3 МПа = 0, 3* 106Па;
t1 = 100 оС;
t2 = 400 оС;
Род газа: аргон
Определить: V2; L; Q; Δ U -?
Решение
1. Определяем удельную газовую постоянную аргона по уравнению универсальной газовой постоянной
µR = 8314, 3 Дж/кгК
R = 8314, 3/39, 994 = 207, 9 Дж/кгК
2. Объём аргона после нагрева можно определить из уравнения состояния для любого количества идеального газа.
Р V2 = mRТ2,
где m (кг) – масса аргона;
R (Дж/кгК) – удельная газовая постоянная;
Т2 = t2 + 273 = 400 + 273 = 673 К – конечная температура аргона;
Р (Па) – удельное давление.
V2 = mRТ2/Р = 0, 55*207, 9*673/0, 3* 106= 0, 26м3
3. Для определения выполненной газом работы в изобарном процессе
L = Р(V2-V1)m (кДж)
Так как РV=RТ, то L = mR (Т2-Т1),
Т1 = t1 + 273 = 100 + 273 = 373 К – начальная температура аргона;
L= 207, 9*0, 55*(673-373)=34303, 5Дж = 34, 3 кДж.
4. Определим тепло, затраченное на нагрев аргона по уравнению:
Q = Ср m (Т2-Т1) кДж,
Q= 0, 5226* 103 *0, 55*300 =86225, 4 Дж = 86, 2 кДж,
Где Ср – массовая теплоёмкость аргона при постоянном давлении.
Ср = µСр/µ = 20, 9*103/ 39, 994= 522, 6 (Дж/кгК)
5. Определим изменение внутренней энергии газа по уравнению первого закона термодинамики:
Q = Δ U+L (кДж),
тогда Δ U = Q-L =86225, 4 - 34303, 5= 51922Дж = 51, 92 кДж.
Ответ: V2 = 0, 26м3; L = 34, 3кДж; Q =86, 2 кДж; Δ U =51, 92кДж.
Задача 2. Определить удельную и объемную теплоемкости воздуха в процессах при постоянных давлении и объеме, считая теплоемкость постоянной. Плотность воздуха при нормальных условиях 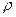 = 1, 29 кг/м3.
= 1, 29 кг/м3.
Решение
Выписываем для воздуха относительную молекулярную массу 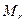 = 28, 96 (приложение Б) и значение молярных теплоемкостей как для двухатомного газа
= 28, 96 (приложение Б) и значение молярных теплоемкостей как для двухатомного газа 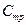 = 29, 1 Дж/(моль. К) и
= 29, 1 Дж/(моль. К) и 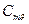 = 20, 8 Дж/(моль. К) (приложение В).
= 20, 8 Дж/(моль. К) (приложение В).
По формуле (1. 4а) определяем:
– молярную массу воздуха
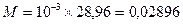 кг/моль.
кг/моль.
Вычисляем по формуле (1. 12):
– изобарную удельную теплоемкость
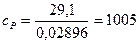 Дж/(кг. К)= 1, 005 кДж/(кг. К),
Дж/(кг. К)= 1, 005 кДж/(кг. К),
– изобарную объемную теплоемкость
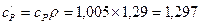 кДж/(м3. К),
кДж/(м3. К),
– изохорную удельную теплоемкость
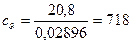 Дж/(кг К)= 0, 718 кДж/(кг. К),
Дж/(кг К)= 0, 718 кДж/(кг. К),
– изохорную объемную теплоемкость
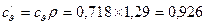 кДж/(м3. К).
кДж/(м3. К).
Задача 3. Какое количество теплоты отводится от 1 кг дымовых газов в газоходе котла, если при постоянном давлении температура их понижается от 600 до 200°С Объемный состав дымовых газов С02=11% 02=7% N2=82%.

Задания
1. Определить расход теплоты на нагрев азота m=4, 2 кг в процессе p=const от t1 oC до t2 oC
| Вариант | |||||||||||||||
| t1, °С | |||||||||||||||
| t2, °С |
2. К 2 кг воздуха подведено 260 кДж теплоты, на сжатие его затрачена работа, равная 150 кДж.
Определить конечный удельный объем, если конечное давление воздуха 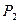 , МПа, а начальная температура
, МПа, а начальная температура 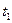 , 0С.
, 0С.
| Вариант | |||||||||||||||
| t1, °С | |||||||||||||||
| P2, МПа | 2, 0 | 2, 1 | 2, 2 | 2, 3 | 2, 6 | 2, 1 | 2, 6 | 2, 9 | 3, 0 | 4, 0 | 3, 1 | 4, 1 | 4, 1 | 4, 1 | 4, 2 |
3. Газообразные продукты сгорания топлива охлаждаются в изобарном процессе от температуры 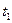 до температуры
до температуры 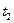 . Состав газов задан в объемных долях:
. Состав газов задан в объемных долях:  ,
, 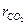 и
и 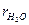 .
.
Найти количество теплоты, отдаваемое 1 кг продуктов сгорания. Объем определен при нормальных условиях.
Исходные данные принять по табл. 1 в зависимости от номера варианта.
Таблица 1. Исходные данные
| Вариант | Объемный состав, % | Вариант | Температуры | |||
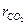
| 
| 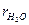
| 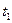 , 0С , 0С
| 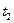 , 0С , 0С
| ||
| 1 500 | ||||||
| 1 400 | ||||||
| 1 300 | ||||||
| 1 200 | ||||||
| 1 100 | ||||||
| 1 000 | ||||||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|