
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
NH4NO2 → N2 + H2O
Категория Аналитическая химическая реакция (выбор)
:: 001:: Аналитическая химическая реакция - это реакция, сопровождающаяся
изменением окраски раствора
определенным аналитическим эффектом за счет образования продукта
реакции, обладающего специфическими свойствами
растворением осадка
образованием осадка
:: 002:: Микрокристаллоскопическая реакция сопровождается образованием
кристаллов характерной формы
кристаллического осадка
мелкокристаллического осадка
окрашенных кристаллов
:: 003:: Селективность аналитической реакции можно повысить
добавлением щелочи
применяя химически чистые реактивы
варьируя pH раствора
маскируя мешающие ионы
:: 004:: Специфические аналитические реакции - это реакции
идущие до конца
с помощью которых в данных условиях можно обнаружить только одно вещество
с помощью которых можно обнаружить все вещества в данных условиях
комплексообразования
осаждения
:: 005:: Аналитическими сигналами в качественном анализе являются
изменение окраски раствора
образование осадка
точка эквивалентности
исчезновение окраски раствора
:: 006:: При работе с пробой объемом 0, 01 - 0, 1 см3 и массой 0, 001 - 0, 01 г используют
макрометод
ультрамикрометод
микрометод
полумикрометод
:: 007:: Требования к качественной аналитической химической реакции
наличие аналитического эффекта
полнота протекания
чувствительность
избирательность
:: 008:: Повысить чувствительность аналитической химической реакции можно
уменьшив концентрацию реагентов
увеличив концентрации реагентов
применяя аналитическое концентрирование
маскированием посторонних ионов
:: 009:: Для понижения предела обнаружения используют
разбавление растворов
каталитические реакции
реакции на носителях
абсолютное концентрирование
:: 010:: Аналитическую химическую реакцию можно сделать избирательной путем
уменьшения концентрации реагентов
применения маскирующих агентов
относительного концентрирования
экстракции
Категория Типы аналитических химических реакций (выбор)
:: 001:: Реакции, используемые в качественном анализе, приводящие к распределению определяемого компонента между двумя фазами
эндотермические
экстракционные
ионного обмена
комплексообразования
:: 002:: Тип аналитической химической реакции
NaСl + K[Sb(OH)6] → Na[Sb(OH)6] + KCl
обмена ионов
комплексообразования
осаждения
окисления-восстановления
:: 003:: Тип аналитической химической реакции
[Ag(NH3)2]Cl + 2HNO3 → AgCl + 2NH4NO3
обмена ионов
комплексообразования
окисления-восстановления
осаждения
:: 004:: Тип аналитической химической реакции
CuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4H2O
обмена ионов
осаждения
комплексообразования
окисления-восстановления
:: 005:: Тип аналитической химической реакции
PbS + 4H2O2 → PbSO4 + 2H2O
обмена ионов
осаждения
комплексообразования
окисления-восстановления
:: 006:: Тип аналитической химической реакции
2 CoСl2 + 12 KCN + Cl2 → 2 K3[Co(CN)6] + 6 KCl
обмена ионов
окисления-восстановления
комплексообразования
осаждения
:: 007:: Окислительно-восстановительные аналитические химические реакции
NaСl + K[Sb(OH)6] → Na[Sb(OH)6] + KCl
6 FeSO4 + K2CrO4 + 7 H2SO4→ 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7 H2O
AlСl3 + 6 KOH → K3[Al(OH)6] + 6 KCl
[Cu(NH3)4]SO4 + K2S → CuS + 4 NH3 + K2SO4
:: 008:: Аналитические химические реакции осаждения
NaСl + K[Sb(OH)6] → Na[Sb(OH)6] + KCl
6FeSO4 + K2CrO4 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
AlСl3 + 6KOH → K3[Al(OH)6] + 6KCl
[Cu(NH3)4]SO4 + K2S → CuS + 4NH3 + K2SO4
:: 009:: Стадии комбинированной аналитической реакции
2AsO 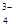 + 5H2S + 6H → As2S3 + 8H2O + 2S
+ 5H2S + 6H → As2S3 + 8H2O + 2S
окисление-восстановление; комплексообразование
окисление-восстановление; осаждение
растворение; окисление-восстановление
нейтрализация; комплексообразование
:: 010:: Стадии комбинированной аналитической реакции
As2S3 + 14H2O2 + 12NH3 → 2AsO 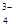 + 3SO
+ 3SO 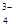 + 12NH
+ 12NH 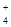 + 8H2O
+ 8H2O
нейтрализация; комплексообразование
окисление-восстановление; осаждение
окисление-восстановление; комплексообразование
окисление-восстановление; растворение
Категория Аналитические реактивы (выбор)
:: 001:: Аналитические реактивы – химические вещества, предназначенные для
проведения химических опытов
поддерживания постоянного значения pH растворов
использования в аналитических, учебных и научно-исследовательских целях
приготовления растворов
:: 002:: Согласно кислотно-основной классификации групповым реактивом II аналитической группы катионов является
Na2CO3
H2S
H2S + HCl
HCl
:: 003:: Согласно кислотно-основной классификации групповым реактивом Ш аналитической группы катионов является
Na2CO3
H2SО4
HCl
NH4OH
:: 004:: Согласно кислотно-основной классификации групповым реактивом V аналитической группы катионов является
Na2CO3
NaOH
HCl
NH4OH
:: 005:: Реактив, с помощью которого можно обнаружить ионы железа (III) в водном растворе, в отсутствии мешающего влияния других ионов
K3[Fe(CN)6]
(NH4)2SO4
NH4SCN
KI
:: 006:: Реактив, с помощью которого можно обнаружить ионы железа (II) в водном растворе, в отсутствии мешающего влияния других ионов
K3[Fe(CN)6]
K4[Fe(CN)6]
NH4SCN
KI
:: 007:: Реактив, с помощью которого можно обнаружить ионы меди (II) в водном растворе, в отсутствии мешающего влияния других ионов
NH3
FeC13
ZnSO4
KI
:: 008:: Реактив для определения ионов аммония
NaNO3
Na2HPO4
К2[HgI4] + КОН
Na3PO4
:: 009:: Соответствие между катионами и реактивами, используемыми для их обнаружения Катион Реактив
Ba2+ K2Cr2O7
Sr2+ NaCl
Ca2+ (NH4)2C2O4
Са2+ (NH4)2SO4
:: 010:: Соответствие между катионами и реактивами, используемыми для их обнаружения Катион Реактив
Ni2+ H2S
Zn2+ NaOH + Br2
Co2+ NH4SCN
Со2+ HNO3
Категория Систематический и дробный качественный анализ (выбор)
:: 001:: При систематическом анализе смеси катионов I и II аналитических групп по кислотно-основной классификации присутствие катионов II аналитической группы устанавливают добавлением раствора
Na2НРО4
H2S
HCl
NH4OH
:: 002:: При систематическом анализе смеси катионов I, II и III аналитических групп по кислотно-основной классификации отделение катионов III аналитической группы проводят добавлением раствора
Na2НРО4
H2SО4
HCl
NH4OH
:: 003:: При анализе выделенной смеси катионов III и IV аналитической группы отделение катионов хрома, алюминия и цинка проводят добавлением избытка раствора
Na2НРО4
H2S
HCl
NaOH
:: 004:: При систематическом анализе выделенной смеси катионов V и VI аналитической групп по кислотно-основной схеме, после выделения VI группы катионов действием NH3+NH4Cl отделение от ионов меди (II) и ртути (II) проводят добавлением раствора
Na2НРО4
H2S
HCl
NH4OH
:: 005:: При систематическом анализе смеси анионов I аналитической группы выделение ионов хлорида, бромида и иодида осуществляют добавлением водного раствора
NH3
NаOH
K3[Co(NO2)6]
AgNO3 + HNO3
:: 006:: При анализе смеси осадков AgCl, AgBr и AgI – отделение хлорид- и бромид-ионов от иодид-ионов осуществляют добавлением 25%-ного водного раствора
Н2SO4
NH3
HNO3
NаOH
:: 007:: Диметилглиоксим используют для обнаружения ионов никеля(II) в присутствии ионов железа(III) при условии добавления в исследуемый раствор
Н2SO4
NH3
KI
NаOH
:: 008:: При систематическом анализе смеси катионов I аналитической группы определению ионов аммония реактивом Несслера мешают ионы
Li +
Na+
Mg 2+
K+
:: 009:: Для обнаружения сульфат-ионов дробным способом используют реактив
BaCl2 + HCl
CaCl2 + HCl
MnCl2 + HCl
MgCl2 + HCl
:: 010:: Для обнаружения фосфат-ионов в пробе минерализата свободного от арсенатов дробным способом используют реактив
гипсовую воду
хлорид бария
бромную воду
молибденовую жидкость
Категория Аналитическая классификация катионов (выбор)
:: 001:: Групповой реагент на катионы Ag(I), Hg(I), Pb(II) при использовании кислотно-щелочной схемы анализа
NH3
NaOH
HCl
H2SO4
:: 002:: Групповой реагент на катионы Ca(II), Sr(II), Ba(II) при использовании кислотно-щелочной схемы анализа
NaOH
H2SO4
NH3
H2S
:: 003:: Групповой реагент на катионы Zn2+, Cr3+, Al3+ при использовании кислотно-основной схемы анализа
NаОН
NH3
H2SO4
HCl
:: 004:: Групповой реагент на ионы As(III), As(V), Sn(II), Sn(IV) при использовании кислотно-основной схемы анализа
NaOH
H2SO4
HNO3
HCl
:: 005:: Групповой реагент на катионы Ag(I), Hg(I), Pb(II) при использовании кислотно-основной схемы анализа
HNO3
NH3
HCl
NaOH
:: 006:: Групповой реагент на катионы Co(II), Ni(II), Cu(II), Cd(II), Hg(II) при использовании кислотно-основной схемы анализа
NaOH
HNO3
H2SO4
NH3
:: 007:: H2S при pH = 0, 5 по кислотно-основной схеме анализа является групповым реагентом для группы катионов
NH 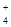 , Na(I), Mg(II), K(I)
, Na(I), Mg(II), K(I)
Ca(II), Sr(II), Ba(II)
Al(III), Cr(III), Mn(II), Fe(III), Co(II), Ni(II)
Cu(II), Cd(II), Hg(II), Bi(III)
:: 008:: H2S при pH 9 по кислотно-основной схеме анализа является групповым реагентом для группы катионов
~NH 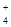 , Na(I), Mg(II), K(I)
, Na(I), Mg(II), K(I)
~Ca(II), Sr(II), Ba(II)
~Al(III), Cr(III), Mn(II)
=Cu(II), Cd(II), Hg(II)
:: 009:: Катионы Co(II), Ni(II), Cu(II), Cd(II), Hg(II) по кислотно-основной схеме анализа относятся к группе
№ 2
№ 3
№ 6
№ 5
:: 010:: Катионы Ca(II), Sr(II), Ba(II) по кислотно-щелочной схеме анализа относятся к группе
№ 1
№ 2
№ 3
№ 5
Категория Реакции обнаружения катионов (выбор)
:: 001:: Ионы аммония в водном растворе можно обнаружить с помощью реакций
BaCl2 + (NH4)2SO4 → BaSO4 + 2NH4Cl
(NH4)2SO4 + H2SO4 → 2NH4HSO4
NH4Cl + NaOH → NH3 + NaCl + H2O
(NH4)2CO3 + 2HCl → 2NH4Cl + CO2 + H2O
:: 002:: Обнаружение ионов калия по реакции
2КС1 + Na3[Co(NO2)6] → K2Na[Co(NO2)6] + 2NaCl
проводят в
нейтральной среде
сильнокислой среде
слабощелочной среде
сильнощелочной среде
:: 003:: Ионы калия в 0, 1 М растворе HC1 можно обнаружить с помощью реакции
КС1 + NaHC4H4O6 → KHC4H4O6 + NaCl
2КС1 + Na3[Co(NO2)6] → K2Na[Co(NO2)6] + 2NaCl
2КС1 + NaPb[Co(NO2)6] → KPb[Co(NO2)6] + NaCl
КС1 + Na2Pb[Cu(NO2)6] → KPb[Cu(NO2)6] + NaCl
:: 004:: Микрокристаллоскопическая реакция обнаружения ионов натрия
CH3COONa + UO2(CH3COO)2 → NaUO2(CH3COO)3
проводится в
нейтральной среде
разбавленной уксусной кислоте
разбавленном растворе щелочи
концентрированном растворе щелочи
:: 005:: Обнаружение ионов магния по реакции
Mg2+ + HPO 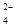 + NH3 → MgNH4PO4
+ NH3 → MgNH4PO4
проводят при рН, равном
:: 006:: Продукты аналитической химической реакции обнаружения ионов калия действием реактива Несслера
NH4Cl + К2[HgI4] + КОН...
KI
Hg(OH)2
HgI2
[I2Hg2NH2]I
:: 007:: Продукты аналитической химической реакции обнаружения ионов калия действием гидротартрата натрия
КС1 + NaHC4H4O6...
NaCl
KNaC4H4O6
KHC4H4O6
K2HC4H4O6
:: 008:: Определению калия по реакции
2КС1 + Na3[Co(NO2)6] → K2Na[Co(NO2)6] + 2NaCl
мешают ионы
Fe3+
Al3+
NH 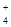
Cs+
:: 009:: Реакцию осаждения MgNH4PO4 проводят
при рН 9
при рН < 7
на холоду
в присутствии ионов Ca2+
:: 010:: Ионы кальция в уксуснокислой среде можно обнаружить реакцией с
хлоридом серебра
нитратом натрия
оксалатом аммония
нитратом аммония
:: 011:: Для обнаружения ионов кальция в водном растворе необходимо добавить насыщенный раствор
BaSO4
SrSO4
MgSO4
(NH4)2SO4
:: 012:: Осаждение катионов стронция в виде его сульфата проводят
при охлаждении
при нагревании
насыщенным раствором сульфата бария
в присутствии аммиачного буферного раствора
:: 013:: Обнаружение ионов Ba 2+ по реакции
2BaCl2 + K2Cr2O4 + H2O → 2BaCrO4 + 2KCl + 2HCl
проводят при pH, равном
3-5
5-6
9-11
:: 014:: Продукты аналитической химической реакции обнаружения ионов бария действием бихромата калия
BaCl2 + K2Cr2O7 + H2O + CH3COONa...
BaCr2O7
BaCrO4
HCl
K2CrO4
:: 015:: Обнаружение ионов Ca 2+ по реакции
CaCl2 + K4[Fe(CN)6] + NH4Cl → CaKNH4[Fe(CN)6] + 3KCl
проводят
при кипячении
в присутствии буферной смеси NH4Cl + NH3
в присутствии ионов Ba 2+
на холоду
:: 016:: Определению ионов кальция по реакции
Ca2+ + C2O 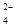 → CaC2O4
→ CaC2O4
мешают ионы
NH 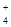
К+
Na+
Sr2+
:: 017:: Определению ионов стронция по реакции
SrCl2 + CaSO4(насыщенный раствор) → SrSO4 + CaCl2
мешают ионы
Ca2+
NH 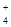
Na+
Mg2+
:: 018:: Определение ионов кальция по реакции
CaCl2 + K4[Fe(CN)6] + NH4Cl → CaKNH4[Fe(CN)6] + 3KCl
проводят при pH, равном
:: 019:: Для обнаружения ионов алюминия(III) в среде с рН = 5 необходимо подействовать
концентрированной серной кислотой
8-оксихинолином
пероксидом водорода
бихроматом калия
:: 020:: Ионы олова(II) с нитратом висмута можно обнаружить путем добавления раствора
NaОН
нитрата натрия
нитрата аммония
нитрита калия
:: 021:: Ионы хрома(III) в щелочной среде можно обнаружить путем добавления раствора
хлорида серебра
нитрата натрия
пероксида водорода
сульфата аммония
:: 022:: Для обнаружения ионов алюминия в среде с рН = 9 необходимо подействовать
при нагревании
NH4OH + NH4CL
пероксидом водорода
бихроматом калия
:: 023:: Для обнаружения железа(II) в кислой среде необходимо подействовать
гексацианоферратом(III) калия
гексацианоферратом(II) калия
роданидом аммония
карбонатом натрия
:: 024:: Для обнаружения ионов железа(III) в кислой среде можно подействовать
пероксидом водорода
концентрированной серной кислотой
гексацианоферратом(II) калия
гексацианоферратом(III) калия
:: 025:: Для обнаружения ионов никеля(II) в щелочной (NaOH) среде необходимо подействовать
нитратом калия
концентрированной серной кислотой
бромной водой
гексацианоферратом(III) калия
:: 026:: Продукты химической реакции
AlCl3 + Nа2S + H2O...
Al2S3
Al(OH)3
Al2O3
HCl
:: 027:: Pеакцию обнаружения ионов Fe2+
Fe2+ + [Fe(CN)6]3-
проводят при pH, равном
:: 028:: Катионы Al3+ осаждают 8-оксихинолином при pH, равном
:: 029:: Ионы Hg2+ в водном растворе можно обнаружить путем добавления
иодида калия
нитрата аммония
хлорида серебра
нитрата натрия
:: 030:: Для обнаружения ионов меди(II) в исследуемый раствор необходимо добавить избыток
карбоната натрия
концентрированной серной кислоты
аммиака
нитрата серебра
:: 031:: Для обнаружения ионов висмута(III) в щелочной (NaOH) среде необходимо подействовать
концентрированной серной кислотой
станнатом(II) натрия
бихроматом калия
нитратом калия
:: 031:: Для обнаружения ионов серебра в водном растворе необходимо подействовать
пероксидом водорода
нитратом калия
иодидом калия
гексацианоферратом(III) калия
:: 032:: Продукты аналитической химической реакции обнаружения ионов
ртути (I) действием аммиака Hg2Cl2 + NH3
HgCl2
HgNH2Cl
Cl2
NCl3
:: 033:: Продукты аналитической химической реакции обнаружения ионов свинца(II) Pb(NO3)2 + К2Cr2O7 + CH3COONa + H2O...
Na2Pb(OH)4
PbCrO4
Na2CrO4
KNO3
:: 034:: Обнаружение ионов свинца реакцией с бихроматом калия проводят
при недостатке ионов Cr2O 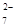
в присутствии HNO3
в присутствии CH3COOH + CH3COONa
в присутствии NaOH
:: 035:: Обнаружение ионов свинца по реакции с бихроматом проводят в среде:
СН3СООН
HCl
HNO3
H2SO4
Категория Предварительные испытания (выбор)
:: 001:: В предварительные испытания входят операции
проверка растворимости вещества в воде и растворах кислот
взвешивание
приготовление раствора точно известной концентрации
определение pH водного раствора
:: 002:: В предварительные испытания входят операции
обнаружение катионов
обнаружение анионов
проведение качественных реакций
обнаружения окислителей
:: 003:: Цвет бесцветного пламени газовой горелки в присутствии солей калия
красный
малиновый
бледно-фиолетовый
желтый
:: 004:: Цвет бесцветного пламени газовой горелки в присутствии солей бария
фиолетовый
красный
малиновый
бледно-зеленый
:: 005:: Цвет пламени газовой горелки в присутствии солей стронция
фиолетовый
зеленый
желтый
карминово-красный
:: 006:: Наименьшее значение рН будет иметь 0, 1 М раствор
HNO3
CH3COOH
CH3COONa
NH4OH
:: 007:: Образуется аммиак при термическом разложении
NH4NO2
NH4NO3
(NH4)2СО3
(NH4)2SО4
:: 008:: Ионы аммония из водного раствора можно удалить с помощью реакций
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
NH4NO2 → N2 + H2O
NH4Cl + NaOH → NH3 + NaCl + H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|