
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Конспект. Донорно-акцепторная связь
Конспект
1. Донорно-акцепторная связь (определение, примеры)
2. Водородная связь (определение, примеры)
Донорно-акцепторная связь
Донорно-акцепторная связь – это разновидность ковалентной связи, которая возникает между двумя атомами за счёт неподелённой электронной пары одного из них.
Данный механизм заключается в обобществлении двумя атомами двух находящихся на внешнем уровне электронов. При этом один из атомов выступает в качестве донора (предоставляет два электрона), а другой - акцептора (имеет вакантную орбиталь для электронов). Атомы s- и p-элементов могут быть либо акцепторами, либо донорами электронов. Атомы d-элементов способны быть и донорами, и акцепторами.
Примеры - образование катионов гидроксония Н3О+ и аммония NH4+
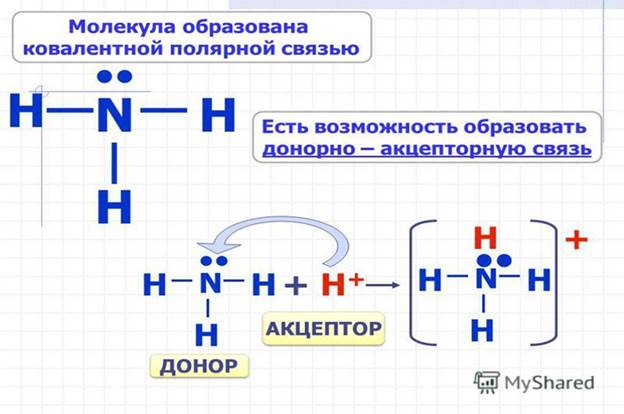
Схематически реакция образования частицы аммония выглядит следующим образом:
NH3 +H+ = NH4+
Электроны в атоме N распределены в следующем порядке: 1s2 2s2 2p3
Электронная структура катиона H: 1s0.
Атом азота на внешнем уровне содержит два s- и три p-электрона. Три p-электрона участвуют в образовании трёх ковалентных обменного типа связей азот-водород N-H. В результате этого образуется молекула аммиака NH3 с ковалентным типом связи. Поскольку атом азота N на внешнем уровне имеет ещё пару электронов s, молекула NH3 может присоединить ещё и катион водорода. Молекула аммиака является донором, а катион водорода H+ – акцептором, который принимает донорские электроны от азота на собственную свободную s-орбиталь.
Пример донорно-акцепторного механизма – H3O+ (ион гидроксония).
Электроны в атоме кислорода распределены в следующем порядке: 1s2 2s2 2p4. Атом кислорода на внешнем уровне имеет два s и четыре p-электрона. Исходя из этого, в образовании связей H-O принимают участие два свободных p-электрона и два s-электрона от двух атомов H. То есть 2 имеющиеся связи в молекуле H2O – ковалентные, образованные по обменному механизму.
Электронная структура катиона водорода: 1s0. Так как у атома кислорода на внешнем уровне остались еще два электрона (s-типа), он может образовать третью связь ковалентного типа по донорно-акцепторному механизму. Акцептором может быть атом, имеющий свободную орбиталь, в данном примере это частица H+. Свободную s-орбиталь катиона H+ занимают два электрона (s) атома кислорода:
Н2О + Н+ → Н3О+

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|