
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СОЕДИНЕНИЯ ЦИНКА
СОЕДИНЕНИЯ ЦИНКА
Оксид цинка ZnO –рыхлый белый порошок, при нагревании желтеет, в воде практически нерастворим, обладает амфотерными свойствами.
Получение:
· Zn(OH)2  ZnO + H2O
ZnO + H2O
· 2Zn + O2 = 2ZnO
Химические свойства:
Реагирует с кислотами и щелочами, кислотными и основными оксидами, восстанавливается коксом
1) 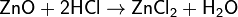
2) 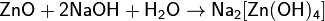
3) ZnO + H2S = ZnS + H2O
4) ZnO + 2NaOH  Na2ZnO2 + H2O
Na2ZnO2 + H2O
5) ZnO + N2O5  Zn(NO3)2
Zn(NO3)2
6) ZnO + SiO2  ZnSiO3
ZnSiO3
7) ZnO + K2O  K2ZnO2
K2ZnO2
8) ZnO + C  Zn + CO
Zn + CO
9) ZnO + BaCO3  BaZnO2 + CO2
BaZnO2 + CO2
Гидроксид цинка Zn(OH)2 –аморфное вещество белого цвета, нерастворимое в воде, обладает амфотерными свойствами.
Получение:
Образуется обменной реакцией между растворимой солью цинка и щелочью:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Химические свойства
Реагирует с кислотами и щелочами, углекислым газом, разлагается при нагревании.
1) Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2) Zn(OH)2 + 2NaOH (конц) = Na2[Zn(OH)4]
3) 2Zn(OH)2 суспензия + СO2 = (ZnOH)2CO3 + H2O
4) Zn(OH)2 + CaO  CaZnO2 + H2O
CaZnO2 + H2O
5) Zn(OH)2 + SiO2  ZnSiO3 + H2O
ZnSiO3 + H2O
6) Zn(OH)2 + 4NH3∙ H2O = [Zn(NH3)4](OH)2 + 4H2O
7) Zn(OH)2  ZnO + H2O
ZnO + H2O
Соли Zn2+ -хорошо растворимы в воде, подвергаются гидролизу по катиону.
Zn(NO3)2 + H2O ↔ ZnOHNO3 + HNO3
Цинкаты разлагаются растворами кислот, при нагревании или разбавлении водой.
1) Na2[Zn(OH)4] + 2HCl (недост) = 2NaCl + Zn(OH)2 + 2H2O
2) Na2[Zn(OH)4] + 4HCl (изб) = 2NaCl + ZnCl2 + 4H2O
3) Na2[Zn(OH)4] + CO2 = Na2CO3 + Zn(OH)2 + H2O
4) Na2[Zn(OH)4] (разбавление) = Zn(OH)2 + 2NaOH
Сульфид цинка ZnS реагирует с растворами кислот и окисляется кислородом воздуха при нагревании (обжиг):
ZnS + 2HCl = ZnCl2 + H2S
2ZnS + 3O2 = 2ZnO + 2SO2
Домашнее задание: Проработать материал по теме, пройти тестирование.
1. Процесс свертывания крови у человека может нарушиться при недостатке в организме: 1) магния, 2) железа, 3) натрия, 4) кальция?
2. Какие вещества придают костям твердость?
1) белки и жиры, 3) глюкоза и гликоген
2) соли кальция и фосфора4) аминокислоты и нуклеиновые кислоты
Б) 1. Расположите металлы в порядке усиления восстановительных свойств:
Са, Ве, Ba, Mg, Sr, Ra.
2. С какими из перечисленных веществ: кислород, сера, хлор, водород, вода, гидроксид натрия, серная кислота, хлорид калия реагирует кальций ?
CaO + H2O→
Mg + H2SO4→
CaCO3→
BaO + H2O→
N2 + Mg→
Ca + P→
Ca(OH)2 + H2SO4→
TiO2 + Mg→
MgO + HCl→
H2SO4+ BaCl2→
Mg(OH)2 →
Для реакций 5 и 6 составьте электронный баланс. Для реакций 7 и 10 составьте полные и сокращенные ионные реакции.
CaO + H2O→
Mg + H2SO4→
CaCO3→
BaO + H2O→
N2 + Mg→
Ca + P→
Ca(OH)2 + H2SO4→
TiO2 + Mg→
MgO + HCl→
H2SO4+ BaCl2→
Mg(OH)2 →
Для реакций 5 и 6 составьте электронный баланс. Для реакций 7 и 10 составьте полные и сокращенные ионные реакции.
CaO + H2O→
Mg + H2SO4→
CaCO3→
BaO + H2O→
N2 + Mg→
Ca + P→
Ca(OH)2 + H2SO4→
TiO2 + Mg→
MgO + HCl→
H2SO4+ BaCl2→
Mg(OH)2 →
Для реакций 5 и 6 составьте электронный баланс. Для реакций 7 и 10 составьте полные и сокращенные ионные реакции.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|