
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
НАХОЖДЕНИЕ В ПРИРОДЕ. ФИЗИЧЕСКИЕ СВОЙСТВА. ПОЛУЧЕНИЕ ЦИНКА. ХИМИЧЕСКИЕ СВОЙСТВА
Дата15.10.2020
Тема: Цинк. Химические и физические свойства.
ЦЕЛЬ: дать характеристику цинку по периодической системе. Изучить получение, химические и физические свойства цинка.
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Электронная формула в основном состоянии 1s22s22p63s23p63d104s2, в возбуждённом состоянии 4s14 p1. В атомах цинка d-подуровень стабилен и его электроны не принимают участия в образовании химических связей, поэтому атомы проявляют степень окисления +2.
НАХОЖДЕНИЕ В ПРИРОДЕ
Элемент цинк находится в составе неорганических веществ:
· Цинковая обманка – ZnS
· Цинковый шпат - ZnCO3
· Цинковая шпинель - ZnO ∙ Al2O3
ФИЗИЧЕСКИЕ СВОЙСТВА
Металл средней активности, при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
ПОЛУЧЕНИЕ ЦИНКА
· Пирометаллургический метод – руду обжигают, а оксид восстанавливают коксом
2ZnS + 3O2 = 2ZnO + 2SO2; ZnO + С = Zn + CO
· Гидрометаллургический – руду обрабатывают раствором серной кислоты, из полученного сульфата цинк выделяют электролизом.
· Электролиз растворов солей цинка
ZnSO4 +2H2O 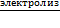 Zn + O2 + H2SO4 + H2
Zn + O2 + H2SO4 + H2
ХИМИЧЕСКИЕ СВОЙСТВА
Цинк – металл, образующий амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Цинк во влажном воздухе покрывается защитной устойчивой гидроксидно-карбонатной плёнкой.
1) С неметаллами
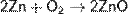
Zn + S = ZnS
Zn + Г2 = ZnГ2 (Г2 = F, Cl, Br, I)
3Zn + 2P = Zn3P2
2) Реагирует с растворами кислот:
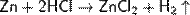
Zn + H2SO4 (разб) = ZnSO4 + H2
3) С кислотами – окислителями:
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 (конц) = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 (конц) = 4ZnSO4 + H2S + 4H2O
Zn + 4HNO3 (конц) = Zn(NO3) 2 + 2NO2+ 2H2O
4Zn + 10HNO3 (разб) = 4Zn(NO3) 2 + 2N2O+ 5H2O
4Zn + 10HNO3 (очень разб) = 4Zn(NO3) 2 + NH4NO3 + 3H2O
4) С растворами щелочей:

Zn + 4NH4OH (конц) = [Zn(NH3)4](OH)2 + H2 + 2H2O
Zn + 2NaOH (тв) 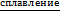 Na2ZnO2 + H2
Na2ZnO2 + H2
5) С оксидами неметаллов и аммиаком:
3Zn + SO2  2ZnO + ZnS
2ZnO + ZnS
Zn + CO2  ZnO + CO
ZnO + CO
3Zn + 2NH3  Zn3N2 + 3H2
Zn3N2 + 3H2
6) С водой (с водяным паром при нагревании)
Zn + H2O  ZnO + H2
ZnO + H2
7) C щелочным расплавом в щелочной среде
3Zn + KClO3 + 6KOH  3K2ZnO2 + KCl + 3H2O
3K2ZnO2 + KCl + 3H2O
8) C солями
Zn + CuSO4 = ZnSO4 + Cu
Zn + 2Na[Ag(CN)2] (p-p) = Na2[Zn(CN)4] + 2Ag
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|