
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Коагуляция. Определение порога коагуляции.
Построение мицеллы золя (продолжение).
Задача. Золь сульфата бария получен смешением равных объемов растворов нитрата серебра и серной кислоты. Написать формулу мицеллы золя и определить, к катоду или аноду в электрическом поле будет перемещаться гранула?
Решение:
Химическая реакция: Ba(NO3)2 + H2SO4 (избыток) = Ba SO4 +2HNO3
Золь
Мr (Ba(NO3)2) = 138·1 + 2·(14·1 + 16·3)=281 Мr (H2SO4) = 1·2 + 32·1 +16·4 =96
V= 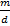 , если объемы равные по условию задачи,то
, если объемы равные по условию задачи,то 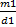 =
= 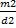 .Отсюда m1 < m2, т.е. H2SO4 (избыток).
.Отсюда m1 < m2, т.е. H2SO4 (избыток).
Строение мицеллы золя:
{( Ba SO4)·m·n SO42- ·2(n-x)H+ } · 2xH+ H+ +NO3-
ядро адсорбционный дифуз. дисперсионная среда

 слой слой
слой слой


 гранула (-)
гранула (-)

мицелла



золь
Так как гранула отрицательно заряжена, то частица будет перемещаться в электрическом поле к положительному аноду.
Задача. Золь бромида серебра получен путем смешивания равных объемов 0.008н раствора бромида кали и 0.0096н раствора нитрата серебра. Определить знак заряда частицы зол и ее направление в электрическом поле.
Решение: Химическая реакция KBr + AgNO3 = AgBr + KNO3
Мr(KBr) = …+…=119 Мr(AgNO3) = 1·…+1·…+3·…=170
1н - 119г 1н - 170г
0.008н -хг х= 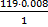 =0.952г 0.0096г – хг х=
=0.952г 0.0096г – хг х= 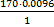 =1.632г избыток AgNO3
=1.632г избыток AgNO3
Структура мицеллы золя:
{(Ag Br)·m·n Ag+·(n-x)NO3- } · x NO3- K+ +NO3-
Cамостоятельно обозначить границы адсорбционного и диффузионного слоев, гранулы и ее заряда, мицеллы золя, дисперсионной среды, границы золя. Движение к катоду или аноду?
Методы получения коллоидных систем: 1.дисперсионный – раздробление грубодисперсных веществ до размеров 1-100 нм, 2. конденсационный – укрупнение частиц за счет слипания атомов или молекул веществ.
Коагуляция – процесс укрупнения коллоидных частиц в результате их слипания.
Седиментация – процесс выпадения или всплытия коллоидных частиц под действием силы тяжести или силы выталкивания. Далеко зашедшая коагуляция.
Коагуляция и седиментация – два взаимопродолжающихся процесса.

 Коагуляция
Коагуляция
скрытая явная:
(невидимая) -осадок, всплытие
-хлопья
-хлопья
-помутнение системы
-цветовые изменения в системе
Факторы, вызывающие коагуляцию: повышение температуры, добавление электролита, прибавление золя с противоположным зарядом гранулы (взаимная коагуляция).
Эти факторы снижают поверхностную энергию и уменьшают поверхность раздела двух фаз.
Причина состоит в том, что диффузионный слой мицеллы золя десольватируется, сжимается. Теряется его способность отталкивать соседние коллоидные частицы. Возрастает действие сил межмолекулярного притяжения. Идет коагуляция с переходом в седиментацию.
Та наибольшая величина ξ(кси) -потенциала, при которой коагуляция протекает с заметной скоростью, называется критической. Для многих золей она составляет 25 – 30 мв. При значениях ξ(кси) –потенциала выше 30мв золи практически устойчивы. Чем величина ξ(кси) –потенциала ниже критической, тем с большей скоростью коагулируют золи. В изоэлектрическом состоянии коагуляция золей протекает с предельной скоростью.
Повышение температуры приводит к повышению коагуляции потому, что тепловое движение частиц снижает сольватацию(гидратацию).
Чаще всего коагуляцию вызывают добавкой электролитов. Для начала явной коагуляции необходимо прибавить к золю некоторое минимальное количество электролита (с), называемое порогом коагуляции. При концентрациях электролита, меньших порога, коагуляция протекает в скрытом состоянии.
Коагулирующая способность Р иона называется величина, обратная порогу коагуляции. Р=  Коагуляцию золей вызывают те из ионов прибавляемого электролита, заряд которых противоположен заряду гранулы золя. Согласно правилу Шульце – Гарди чем выше валентность коагулирующего иона, тем сильнее выражено его коагулирующая способность.
Коагуляцию золей вызывают те из ионов прибавляемого электролита, заряд которых противоположен заряду гранулы золя. Согласно правилу Шульце – Гарди чем выше валентность коагулирующего иона, тем сильнее выражено его коагулирующая способность.
Коагулирующая способность ионов одной и той же валентности зависит от гидратации ионов. Чем больше гидратация, тем больше порог коагуляции и ниже коагулирующая способность иона. Порог коагулции у золей невелик и выражается в миллимолях или миллиграмм-эквивалентах на 1л золя ( 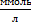 или
или 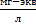 ).
).
Дл золя As2S3 c отрицательной гранулой электролиты К+ , Ba2+ , Al3+ вызывают коагуляцию. Р(К+) : Р(Ba2+) : Р(Al3+) =1:72:540. Чем выше степень окисления, тем выше коагулирующая способность и меньше порог коагуляции.
Задача 1.В три колбы налито по 100см3 (мл) золя Fе(ОН)3.
Для того, чтобы вызвать коагуляцию золя, потребовалось добавить: в первую колбу – 10.5 мл 1н.раствора хлорида калия, во вторую - 62.5мл 0.001н.раствора фосфата натрия. Вычислить порог коагуляции каждого электролита и определить знак заряда частиц золя.
Решение: заряд ионов металлов одинаков(+). А количество веществ для коагуляции разное. Не они коагулянты, а анионы. Гранула мицеллы золя заряжена положительно.
Для КСl: масса его в растворе (10.5мл·1н):1000=0.0105г или 10.5мг СКСl=10.5:(100+10.5)=95мг/л
Для Na2SO4 : масса его в растворе (62,5·0.01н):1000=0.000625г или 0.625мг. С Na2SO4=0.625: (100+62,5)=3.8 мг/л
Для Na3PO4 : масса его в растворе (37.0·0.001н):1000= 0.000037г или 0.037мг. С Na3PO4 =0.037: (100+37)=0.27 мг/л.
Задача 2. Пороги коагуляции золя Fе(ОН)3 для электролитов КJ и K2Cr2O7 соответственно равны10,0 и 0,195 ммоль на 1л золя. Во сколько раз коагулирующая способность бихромата калия больше, чем у иодида калия?
Решение: Р КJ= 1:10 = 0.1 Р K2Cr2O7= 1:0.195 =5.1 Р КJ : Р K2Cr2O7= 0.1:5.1 = 1:51.
Задача 3. Пороги коагуляции электролитов для золя иодида серебра в ммоль/л оказались равными
сKCl= 256.0 cBa(NO3)2=6.0
cKNO3=260.0 cSr(NO3)2=7.0 cAl(NO3)3= 0.067
Какой заряд частиц данного золя? Вычислить коагулирующую способность каждого из электролитов.
Решение: Коагуляцию вызывают катионы. Поэтому гранула заряжена отрицательно.
Коагулирующая способность: 1/c(KCl)=1/256=0.0039 1/c(KNO3)= 1/260=0.003846 1/c(Ba(NO3)2)= 1/6=0.167
1/c Sr(NO3)2= 1/ 7=0.1428 1/c Al(NO3)3=1/0.067= 14.9
Глина и песок имеют в воде отрицательный заряд гранулы мицеллы золя. Пример мутная вода реки Урал.
Для её очистки применяют сульфат алюминия. Коагулянт взаимодействует с водой
Al2(SO4)3 +6H2O = 3H2SO4 + 2Al(OH)3
Строение мицеллы золя:
{(Al(OH)3·m·2n Al3+·3(n-x)SO42- } ·3 x SO42- 6H+ +3SO42-
Гранула положительно заряжена, а в реке отрицательно. Происходит притяжение и совместное выпадение золей.
Тест
Коагуляция. Определение порога коагуляции.
1.Закончите предложение: процесс укрупнения коллоидных частиц в результате их слипания – это …
2. Закончите предложение: процесс выпадения коллоидных частиц в осадок под действием силы тяжести или всплытия их под действием сил выталкивания – это … (коагуляция, седиментация, поверхностная энергия.)
3. Закончите предложение: седиментация – это далеко зашедшая … .
4.Два взаимопродолжающиеся процесса – это:
А. коагуляция и поверхностная энергия. Б.коагуляция и седиментация. В. седиментация и поверхностная энергия.
5.Исключите лишнее. Коагуляция классифицируется на: А. скрытую Б. невидимую В. явную Г.неявную.
6. Найдите соответствие:
| Коагуляция | Явления при коагуляции |
| 1. Скрытая 2. Явная | А.выпадение осадка или всплытие частиц Б.образование хлопьев В.помутнение дисперсионной среды Г.изменение цвета дисперсионной среды Д.изменения не фиксируются невооруженным взглядом. |
7.Взаимная коагуляция – это осаждение золей при добавлении золя с зарядом :
А.одинаковым с гранулой мицеллы золя Б. противоположным грануле мицеллы золя.
8.Факторы, снижающие поверхностную энергию коллоидной системы:
А. изменение температуры Б. добавление электролита В. добавление другого золя с противоположным зарядом гранулы Г. все ответы верны.
9.Критическим кси-потенциалом для коллоидных систем является поверхностная энергия в мВ:
А. 10 Б. 15 В. 25-30 Г. более 30.
10. При критическом кси-потенциале для коллоидных систем скорость коагуляции:
А. минимальная Б. максимальная В. постоянная.
11.При изменении рН системы белков коагуляция с последующей седиментацией :
А. наблюдается Б. не наблюдается.
12. Минимальное количество электролита, добавленного в дисперсную систему, вызывающее явную коагуляцию, называют:
А. кси-потенциалом Б. порогом коагуляции В. сольватацией.
13. Закончите предложение: величина, обратная порогу коагуляции, называется … .
14.Правило Шульце – Гарди определяет коагулирующее действие иона электролита от:
А. концентрации Б. температуры В. валентности.
15. Коагулирующая способность ионов электролита с одинаковой валентностью от гидратации их:
А. зависит Б. не зависит.
16. При больщой гидратации:
А. порог коагуляции больше, Р меньше. Б. порог коагуляции меньше, Р больше.
17. Единица измерения коагуляции: А. ммоль/л Б. мг-экв/л В. мВ.
Ранжирование: «5»- 20 баллов. «4»- 16-19 баллов. «3»- 12-15 баллов. «2»- менее 11 баллов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|