
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ход работы
Ход работы
Опыт №1. Определение постоянной величины прибора.
Постоянная прибора (Z) – это количество теплоты, необходимой для измерения температуры термостата на 10С.
Постоянную температуру можно определить по теплоте растворения любого вещества. В данной работе она определяется по теплоте растворения КСl и рассчитать по формуле:
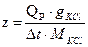
где
g – навеска KCl, г
M – молярная масса KCl, г/моль
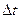 = 1 с
= 1 с
Q – теплота растворения KCl = 4440 кДж/моль
тогда Z = 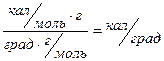 Z =
Z = 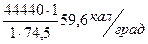
Опыт №2. Определение теплоты растворения веществ в жидкостях с помощью термостата.
1. Ознакомиться с работой прибора.
2. Налить в стакан 250 г дистиллированной воды. Через 5 мин. перемешать воду и точно измерить температуру воды в термометре (после ее стабилизации) t1
3. Взвесить 50гр. сухого NaCl, высыпать его в воду.
4. После растворения соли измерить температуру растворения 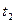
5. Данные опыта занести в таблицу.
6. Повторить последовательно опыты с другими веществами: (NH4NO3, NaOH, CuSO4, CuSO4×5H2O)
 Дата
Дата
Таблица
| № п/п | Наименования вещества | Вес вещества,г | Молярная масса г/моль | Тем-ра вещества 0С | Δt 0С | Qp | |
| кал/ моль | кДж/ моль | ||||||
| H2O | |||||||
| NaCL | |||||||
| NaOH | |||||||
| NH4NO3 | |||||||
| CuSO4 | |||||||
| CuSO4×5H2O | |||||||
Расчетная формула
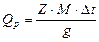
Qp – теплота растворения, кал/моль
Z – постоянная термостата, кал/град
М – молярная масса растворенного вещества, г/моль
Δt – изменение температуры,0С
g – навеска вещества, г в 250г воды
Опыт №3. Определение теплоты гидратации.
Гидратация – процесс соединения молекул веществ с молекулами воды при растворении в жидкостях.
CuSO4 + 5H2O = CuSO4 ×5H2O
Общий тепловой эффект – сумма теплот растворения безводной соли и кристаллогидрата.
Qгидр = Qбезвод – (- Qкрист)
1. Взвесить на весах CuSO4 20 – 30г., отобрать 100 – 200мл Н2О
2. Измерить температуру воды и добавить в медный купорос, отметить температуру реакции.
3. Осторожно добавить в данный раствор 1г цинковой пыли. Отметить температуру реакции.
4. Произвести расчет теплоты.
Расчеты:
 Дата
Дата
Контрольные вопросы:
1. Что называется тепловым эффектом химической реакции?
2. Закон Гесса, пример.
3. Напишите формулы для расчета тепловых эффектов химических реакций: а) по теплотам образования исходных веществ и продуктам реакции; б) по теплотам сгорания исходных веществ и продуктов реакции.
4. Напишите формулу показывающую, в каком соотношении находятся энтальпия, внутренняя энергия, данной термодинамической системы.
5. Какой знак будет иметь величина G для процесса перехода вещества в различные агрегатные состояния?
Пример: рассчитать теплоту растворения нитрата аммония (кДж/моль), ести температура растворения 5г навески нитрата 19,2С, температура воды 22,50С. Постоянная термостата 6,47 кДж/град.
 Дата
Дата