
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ионная химическая связь –это химическая связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
2. Ионная химическая связь –это химическая связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
Наиболее устойчивая электронная конфигурация атомов 8 электронов - 2s22p6 и 2 электрона - 1s2.
Me0 -nẽ ↔ Men+ (катионы)
неMe0 +nẽ ↔ неMen- (анионы)
Образуется ионная кристаллическая решётка
Физические свойства: твёрдые, прочные, тугоплавкие.
Растворы и расплавы ионных соединений – электролиты.
- Что такое электролиты?
- Определение электролитической диссоциации?
- Три случая образования электролитов?
Ионная связь – крайний случай ковалентной полярой связи, но в оличие от неё связь ненаправленная.
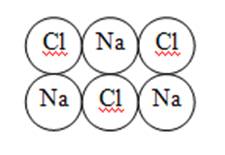
3. Металлическая связь –связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решётке.
Характеристика – ненаправленная, ненасыщенная, небольшое количество валентных электронов, большое количество свободных орбиталей.
Me0 -nẽ ↔ Men+
Физические свойства – твёрдость, тепло- и электропроводность, ковкость, пластичность, металлический блеск.
Металлическая кристаллическая решётка – в узлах ионы или атомы металлов, между которыми свободно перемещаются электроны.
4. Водородная химическая связь –это химическая связь между положительно поляризованными атомами водорода одной молекулы (или её части) и отрицательно поляризованными атомами сильноэлектроотрицательных элементов, имеющих неподелённые электронные пары (F, O, N, реже Cl и S) другой молекулы или другой её части.
Характер связи: частично электростатический, частично донорно-акцепторный.
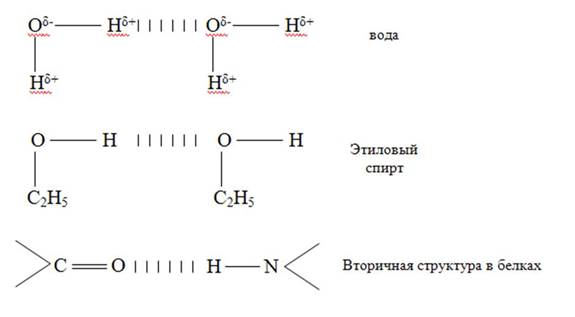
В молекулах ДНК цепи нуклеотидов связаны водородными связями в двойные спирали - принцип комплементарности (Ц-Г, А-Т).
Вещества с водородными связями имеют молекулярные кристаллические решётки.
Единаяприродахимическойсвязи.
Ионная химическая связь – крайний случай ковалентной полярной химической связи. Металлическая связь совмещает в себе ковалентное взаимодействие атомов и электростатическое притяжение между ионами металлов и их электронами.
LiF – 80% ионной связи и 20% ковалентной полярной.
Основания: между кислородом и водородом в гидроксогруппе о ковалентная полярная связь, между металлом и гидроксогруппой – ионная.
Соли: в кислотном остатке – ковалентная полярная, между металлом и кислотным остатком – ионная.
Домашнее задание:
1.Из предложенного перечня выберите два вещества, в которых присутствуют только ковалентные полярные связи.
1) КNO3
2) C (алмаз)
3) SiO2
4) HNO3
5) Na2S
.
2. Из предложенного перечня выберите две пары веществ, для каждой из которых характерна ковалентная полярная связь.
1) углекислый газ и сероводород
2) азот и аммиак
3) вода и хлороводород
4) хлороводород и хлорид натрия
5) оксид лития и гидроксид лития
3. Из предложенного перечня выберите два вещества, в которых кислород образует ионные связи.
1) озон
2) оксид кальция
3) углекислый газ
4) оксид меди
5) вода
4. Из предложенного перечня выберите два вещества, для которых характерна водородная связь.
1) фенол
2) алкан
3) арен
4) спирт
5) алкин
5.Из предложенного перечня выберите две пары веществ, в которых расположены только соединения с ковалентной неполярной связью.
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
5) фтор и сера
1. Определить вид химической связи в соединениях. Обосновать ответ:
ВаСl2; SO2; С2Н6; F2; КВr; I2.
2. В каком из указанных соединений наиболее полярная связь? Расположить соединения в порядке возрастания полярности:
HCl; F2; Н2O; NH3; H2S
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|