
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ковалентная химическая связь –это связь, возникающая между атомами за счёт общих электронных пар.
Дата 29.10.2020
Тема урока:Основные виды химической связи. Ионная и ковалентная связь. Металлическая связь.
Цель урока:сформировать понятие о химической связи и научить учащихся определять ее тип в различных соединениях по химической формуле вещества.
Химическая связь –это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
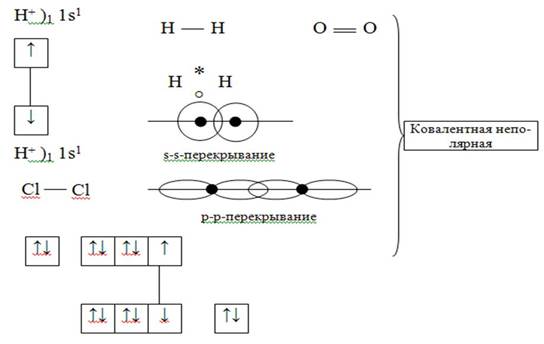
1. Ковалентная химическая связь –это связь, возникающая между атомами за счёт общих электронных пар.
- Что вы знаете о ковалентной химической связи?
Стремление к устойчивой электронной конфигурации за счёт образования общих электронных пар.
1) Обменный механизм
2) Донорно-акцепторный механизм
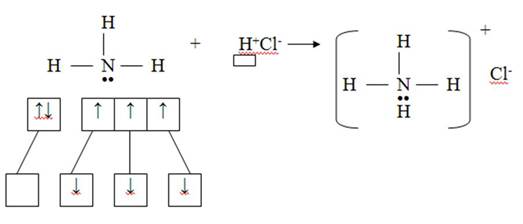
Азот – донор (имеет электронную пару), водород – акцептор (имеет свободную орбиталь)
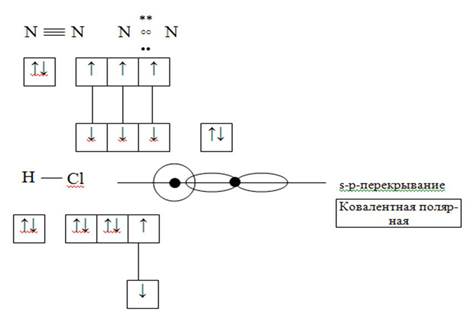
По числу общих электронных пар (по кратности).
1) Одинарные.
2) Двойные.
3) Тройные.
По степени смещения.
1) Полярные.
2) Неполярные.
- Что такое электроотрицательность?
Электроотрицательность –это способность атомов химических элементов оттягивать на себя общие электронные пары, находящиеся в совместном владении
Неполярная –ковалентная химическая связь, образующаяся между атомами с одинаковой электроотрицательностью.
Полярная – ковалентная химическая связь, образующаяся между атомами с разной электроотрицательностью.
Молекула углекислого газа неполярная, так как имеет линейное строение
Кристаллическая решётка веществ с ковалентной химической связью: атомная и молекулярная. Атомная – очень прочная (графит, алмаз), молекулярная – газы, легколетучие жидкости, твёрдые легкоплавкие вещества (хлор, вода, йод, углекислый газ – «сухой лёд»). Молекулярная кристаллическая решётка непрочная, так как внутримолекулярные связи прочные, межмолекулярное взаимодействие слабое.
- Что вы знаете об ионной связи, ионной кристаллической решётке?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|