
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
со щелочами. с галогеноводородами
6) со щелочами
Кремний реагирует со щелочами очень энергично, проявляя слабо-кислые свойства:
Si+2NaOH+H2O=Na2SiO3+2H2
7) с галогеноводородами
Кремний реагирует с галогеноводородными кислотами, образуя галогениды кремния:
· н.у.Si+4HF→4н.у.SiF4+2H2
· Si+4HCl→300∘CSiCl4+2H2
· Si+4HBr→500∘CSiBr4+2H2
ОКСИД КРЕМНИЯ(IV) SIO2

или диоксид кремния, кремнезем. Твердое, очень тугоплавкое, кристаллическое вещество, нерастворимое в воде и не вступающее с ней во взаимодействие.
Оксид кремния(IV) - высший оксид кремния, проявляет окислительные свойства. При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний:
SiO2+2Mg=Si+2MgO
3SiO2+4Al=3Si+2Al2O3
или при избытке восстановителя – силициды:
SiO2+4Mg=Mg2Si+2MgO
Реагирует с водородом:
SiO2+2H2=Si+2H2O
Взаимодействует с углеродом с образованием карборунда (карбида кремния):
СSiO2+3C=SiС+2CO
По химическим свойствам оксид кремния (IV) относится к кислотным оксидам.
С оксидом кремния (IV) непосредственно реагирует только плавиковая кислота:
SiO2+4HF=SiF4+2H2O.
При сплавлении оксида кремния (IV) со щелочами, основными оксидами и карбонатами щелочных металлов образуются соли кремниевой кислоты — силикаты:
SiO2+2NaOH=Na2SiOO3+H20
SiO2+CaO=CaSiO3
SiO2+K2CO3=K2SiO3+CO2
SiO2+H2O≠
Эти реакции лежат в основе производства стекла. Диоксид кремния широко распространен в природе. Кристаллический оксид кремния – это кварц, горный хрусталь, халцедон, яшма, основа кварцевого песка. Очень твердое, прочное, тугоплавкое вещество. При обычном давлении и температуре существуют три кристаллические модификации SiO2: кварц, тридимит и кристобалит. Для каждой модификации известны низкотемпературные α- и высокотемпературные β-формы. Все они построены из тетраэдров SiO4, соединенных с другими тетраэдрами всеми четырьмя атомами кислорода в трехмерные решетки.
Взаимное расположение тетраэдров в различных модификациях совершенно различно, но между собой α- и β- формы отличаются незначительно, поэтому между ними превращения протекают при низких температурах, а взаимные переходы между различными модификациями требуют разрыва связей Si – O – Si, поэтому они протекают при высоких температурах и довольно медленно.
КРЕМНИЕВАЯ КИСЛОТА H2SIO3
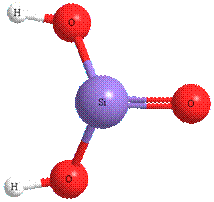

твердое аморфное вещество, представляющее собой полимерную структуру, практически нерастворимо в воде, поэтому катионы водорода в воде практически не отщепляются.
В связи с этим такое общее свойство кислот, как действие на индикаторы, H2SiO3 не обнаруживает, она еще слабее угольной кислоты.
H2SiO3 — непрочная кислота и при нагревании постепенно разлагается:
H2SiO3→t∘CSiO2+H2O
.
СИЛИКАТЫ - СОЛИ КРЕМНИЕВОЙ КИСЛОТЫ MSiO3
Соли кремниевой кислоты – силикаты SiO32−. Обычно они нерастворимы в воде, исключения составляют силикаты натрия и калия, их называют «жидким стеклом».
Силикаты проявляют типичные свойства средних солей.
Взаимодействуют с кислотами с образованием нерастворимой кремниевой кислоты:
Na2SiO3+2HCl=2NaCl+H2SiO3
Взаиодействуют с угольной кислотой (единственная кислота, которая слабее кремниевой):
Na2SiO3+C02+H20=Na2CO3+H2SiO3↓
Силикаты широко распространены в природе. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).
Стекло – тоже силикат. Состав обычного оконного стекла: Na2O⋅CaO⋅6SiO2 Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2+Na2CO3+CaCO3=Na2O⋅CaO⋅6SiO2+2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы:
· Pb2+ – хрусталь;
· Cr3+ – имеет зеленую окраску,
· Fe3+ – коричневое бутылочное стекло,
· Co2+– дает синий цвет,
· Mn2+ – красновато–лиловый.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|