
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
с кислотами
Строение кремния
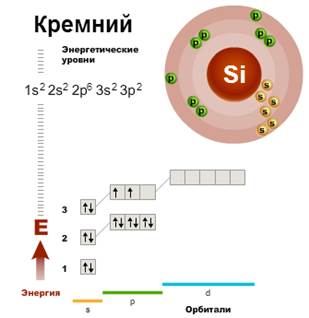
Кремний - элемент третьего периода главной подгруппы IV группы Периодической системы химических элементов Д.И. Менделеева. Электронное строение атома кремния отражается конфигурацией:
1s22s22p63s23p2
На внешнем энергетическом уровне атома углерода содержится 4 электрона, поэтому максимальная валентность кремния - IV. Кремний проявляет степени окисления:
· Si0+4e¯→Si−4 окислитель
· Si0−2e¯→Si+2 восстановитель
· Si0−4e¯→Si+4 восстановитель
Кремний – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
Аллотропные модификации кремния
Различают аморфный и кристаллический кремний.
Нахождение в природе
Кремний – второй по распространенности элемент на Земле после кислорода. В свободном виде кремний не встречается, бывает только в виде соединений. Наиболее химически устойчивым соединением кремния является оксид кремния (IV), или кремнезем. Кристаллический кремнезем находится в природе главным образом в виде песка и минералов: кварца, горного хрусталя.
Кремний входит в состав многих полудрагоценных камней (агат, аметист, яшма и др.) и в состав породообразующих минералов – силикатов и алюмосиликатов (полевых шпатов, глин, слюд и др.).
Получение кремния
Кремний применяют главным образом для изготовления полупроводниковых приборов, в том числе солнечных батарей, получения сплавов, восстановления металлов из оксидов.
В лаборатории: кремний получают из кремнезема(SiO2) восстановлением магнием или алюминием:
SiO2+2Mg=Si+2MgO
3SiO2+4Al=3Si+2Al2O3
В промышленности его также получают восстановлением из оксида. В качестве восстановителя используют кокс:
SiO2+2C=Si+2CO
Кремний, полученный таким образом, содержит примеси, поскольку может напрямую взаимодействовать с углеродом: Si+C=SiC (карбид кремния)
Для получения чистого кремния используют другой способ: тетрахлорид кремния восстанавливают водородом при 1200 °С:
SiCl4+2H2→1200∘CSi+4HCl
или проводят термическое разложение силана:
SiH4→t,∘CSi+2H2↑
Химические свойства кремния
Кремний — темно-серое вещество с металлическим блеском. Он хрупок и, как и углерод, тугоплавок. Обладает полупроводниковыми свойствами. В химических реакциях проявляет свойства восстановителя.
ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
1) c металлами:
Окислительные свойства почти не характерны для кремния, однако при взаимодействии с металлами кремний восстанавливается, образуя силициды MenSi:
Si+2Mg=Mg2Si
2) с галогенами:
В силу высокой инертности непосредственно взаимодействует только со фтором, при этом проявляет восстановительные свойства:
Si+2F2=SiF4
С хлором реагирует при нагревании до 400–600 ∘C:
Si+2Cl2→400−600∘CSiCl4
3) с кислородом:
Измельченный кремний при нагревании до 400–600 ∘C реагирует с кислородом:
Si+O2→400−600∘CSiO2
образует также соединение с водородом — силан SiH_4 (аналог метана): НSi+2Н2=SiH4.
4) с другими неметаллами:
При очень высокой температуре около 2000 ∘C, образуя карбид кремния SiC- карборунд, кристаллическое, построенное по типу алмаза вещество):
Si+C→2000∘CSiC
При 1000 ∘C реагирует с азотом, образуя нитрид кремния ( Si3N4):
3Si+2N2→1000∘CSi3N4
С водородом невзаимодействует.
ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
5) с кислотами
Кремний устойчив к действию кислот, в кислой среде он покрывается нерастворимой пленкой оксида и пассивируется. Кремний взаимодействует только со смесью плавиковой и азотной кислот:
3Si+4HNO3+18HF=3H2[SiF6]+4NO+8H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|